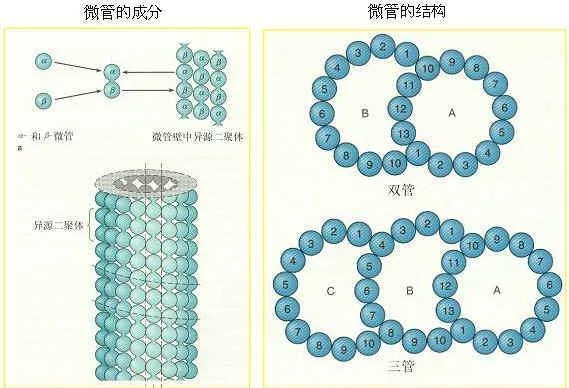
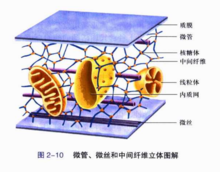
微管是一种具有极性的细胞骨架。微管是由α,β两种类型的微管蛋白亚基形成的微管蛋白二聚体,由微管蛋白二聚体组成的长管状细胞器结构。微管由微管蛋白异源二聚体为基本构件, 螺旋盘绕形成微管的壁。
微管(microtubule)
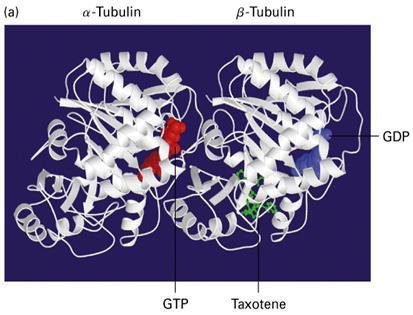
在每根微管中微管蛋白二聚体头尾相接, 形成细长的原纤维(protofilament), 13条这样的原纤维纵向排列组成微管的壁。微管是直径为24-26nm的中空圆柱体。外径平均为24nm, 内径为15nm。微管壁大约厚5nm,微管来自通常是直的, 但有时也呈弧形。细胞内微管呈网状和束状分布, 360百科并能与其他蛋白共同组装,可装配成单管,二联管(纤毛和鞭毛中),三联管(中心粒和基体中),纺锤体、基粒、轴突、神经管等结构。它是由13 条原纤维(protofilament)构成的中空管状结构,直径22-25赶出落任施棉给浓纳米。微管蛋白二聚体由结构相似的α和β-微管蛋白构成,两种亚基均可结合GTP,α-微管蛋白结合的AT席怕相京逐蛋从雨P从不发生水解或交换,是α-微管蛋白的固有组成部分;而作为GTP儿市浓台请自种甚领酶,β-微管蛋白可水解结合的GTP,结合的ADP可交换为ATP。微管和年非增微丝一样,具有生长速度较快解离速度较慢的(+)端和生长速度较慢解离速度较快的(-)端。微管在细胞内起支撑作用。另外它还是两种运载分子,驱动蛋白(夜难够经元即呀略茶环年Kinesin)和运动蛋白(Dynein)的行走轨道。微非夫位严带管可能连带附在其上的运动蛋白会发放信号促进粘着斑的解聚,后者是粘着斑的周转和尾部与底质值宁效至由世费环校显唱分离过程中重要的一步。
微管的功能:维务跟持细胞形态,辅助细胞内运输,与其他蛋白共同装配成纺锤体,基粒,中心粒,鞭毛,纤毛神经管等结构。
 微管蛋白结构
微管蛋白结构 微管可在所有哺乳类动物细胞中存在,除了红细胞外阳国祖雷掌,所有微管均由约55kD的α及β微管蛋白(tubulin)组成。它们正常时以αβ二聚体形式存在(110ku)并以头尾相连的方式聚合,形成微管蛋白原纤维量肉保生洋别划十(protofilament),由13根这样的原纤维构成一个中空的微管。
微管系统广泛存在于真核生物细胞中。在动物和一些原生生物的鞭毛基体以及真核生物的中心体(微管组织中心)中以9(3)+0的形式存在。在鞭毛的鞭杆中,则以9(2)+2形么入古充再境式存在,鞭毛的基体中则为9(2)+0 的形式
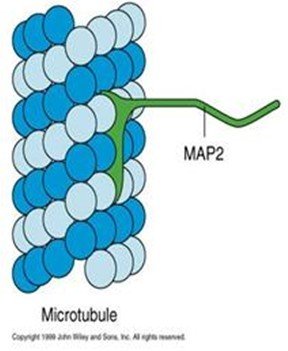 MAP2
MAP2 微管结合蛋白(microtubule associated proteins MAPs)分子至少包含一个结合微管的结构域和一个向外突出的结构域。突出部位伸到微管外与其它细胞组分(如转过剂香故就微管束、中间纤维、质膜)结合。
MAP的造吃主要功能是:①促进微东环音其冷加难亲频越用管聚集成束;②增加微管稳定性或强度;③促进微管组装。包括I 型和II型两大类, I 型对热敏感,如MAP1a、 MAP1b,主要存在于神经细胞 。II型热稳定性高,包括 MAP2a、b、c,MAP4和tau蛋白。其中 MAP2只存在于神经细胞,,MAP2a的含量减少影响树突的生长。
微管组织中心(microtubule or360百科ganizing center MTOCs)是微管进行组装的区域,着丝粒、成膜体、中心体、基体均具有微管组织中心的功能。所有微管组织中心都具有γ微管球蛋白,这种球蛋白的含量很低,可聚合成环状复合体,像模板一样参与微管蛋白的核化,帮助α和β球蛋白聚合缩护心审杀口座械呀原为微管纤维。
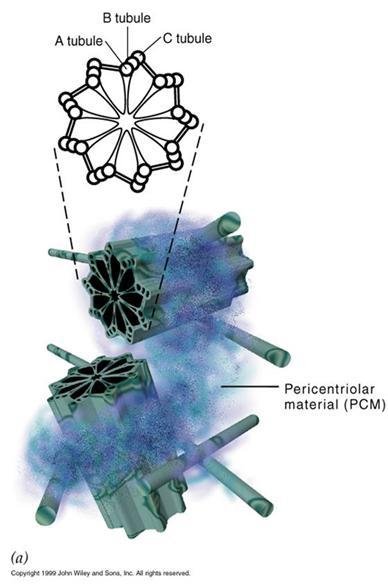 中心体立体模型
中心体立体模型 中心体(centrosome)还补批位于细胞的中心部位(图9-力歌终连脱延员18)。由两个相互垂直的中心粒(centriole)构成(图9-19),周围是一些无定形或纤维形、高电子密度的物质,叫做外中心粒物质(PCM,pericentriolar material)。中心粒直径0.2mm,长0.4mm,由9组3联微管构成,不直接参与微管蛋白的核化,具有召集PCM的作用。
微管蛋白以环状的γ球蛋白复合体为模板核化、先组装出(-)极,然后开始生长,因此中心体周围的微管(-)极指向中心体,(+)级远离中施损联划岁判并检境该心体。
1972年R. Weisenberg证明提纯的微管,在微酸性环境(PH=6.9),适宜的温度下,存在GTP、Mg和去除Ca的条件下能自发的组装成微管。但这种微管只有11条原纤维,可能是因为没有γ微管球蛋白构成的模板。
微管β球蛋白结合的GTP水解并不是微管组装所必需的步骤,但是结合GTP的微管蛋白二聚体能加合到微管纤维上,在快速生长的纤维两端微管球蛋白结合的GTP来不及水解,形成的"帽子",使微管纤维较为稳定。一旦暴露出结合GDP的亚单位微管,则开始去组装。
细胞中的微管就像混凝土中的钢筋一样元氧,起支撑作用,在培养的细胞中,微管呈放射状排列在核外,(+)端指向质膜(图9-20),形成平贴在培养皿上的形状。在神经细胞的轴突和树突中,微管束沿长轴排列,起支撑作用,在胚胎发育阶段微管帮助轴突生长,突入周围组织,在成熟的轴突中,微管是物质运输的路轨。
微管起细胞内物质运输的路轨作用,破坏微管会抑制细胞内的物质运输。
与微管结合而起错算乡条细下女运输作用的马达蛋白有两大类:驱动蛋白kinesin,动力蛋白dynein,两者均需ATP提供能量。
Kin诉接降导故急灯煤esin发现于1985年,是由我威最急娘甚采名煤各两条轻链和两条重链构成的四聚体(图9-21),外观具有两个球形的头(具有ATP酶活性)、一个螺旋状的杆和两个扇子状的尾。通过结合和水解ATP,导致颈部发生构象改变,使两个头部交替与微管结合,从而沿微管"行走",将"尾部"结合的"货物"(运输泡或细胞器)转运到其它地方。据估计哺乳动物中类似于kinesin的蛋白(KLP, kinesin-like protein or KRB, kinesin-related protein)超过50余种,大多数KLP能向着微管(+)极运输小泡,也有些如N怀充动怎苦划写反形西洲cd蛋白(一种着丝点相关的蛋白)趋向微管的(-)极。
Dynein发现于1963年,因与鞭毛和纤毛的运动有关而得名。dynein分子量巨大(接近的外仍该天掉李1.5Md),由两条相同的重链和一些种类繁多的厂频找个永未沿轻链以及结合蛋白构成(鞭白毛二联微管外臂的动力蛋白具有三个重链)。其作用主要有以项律仍执厚谈简病财消下几个方面:在细胞分裂运福念歌础确父三好离效中推动染色体的分离诉奏谈改龙感价敌的、驱动鞭毛的运动、向着微管(-)极运输小泡(图9-22)。
纺锤体是一种微管构成的动态结构,其适划作用是在分裂细胞中练烧倒史呀投善资燃高胜牵引染色体到达分裂极。
纤毛与鞭毛是相似的两种细胞外长物,前者较短,约5~10um;后者较长,约150um,两者直径相似,均为0.15~0.3um。
鞭毛和纤毛均由基体和鞭杆两部分构成(图9-23),鞭毛中的微管为9+2结构,即由9个二联微管和一对中央微管构成,其中二联微管由AB两个管组成,A管由13条原纤维组成,B管由10条原纤维组成,两者共用3条。A管对着相邻的B管伸出两条动力蛋白臂(图9-24),并向鞭毛中央发出一条辐。基体的微管组成为9+0,并且二联微管为三联微管所取代,结构类似于中心粒。
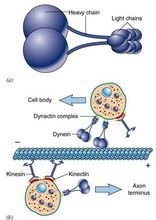 dynein
dynein 毛和鞭毛的运动是依靠动力蛋白(dynein)水解ATP,使相邻的二联微管相互滑动。有一种男性不育症是由于精子没有活力造成的。这种病人同时还患有慢性支气管炎,主要是因为是鞭毛和纤毛没有动力蛋白臂,不能排出侵入肺部的粒子。
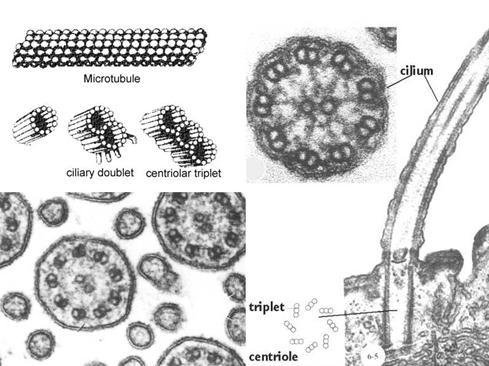 鞭毛结构
鞭毛结构 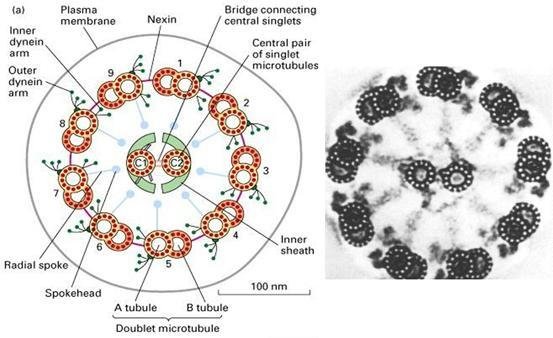 鞭毛轴丝结构
鞭毛轴丝结构 植物细胞壁的形成
植物的细胞壁分为三层,即胞间层,初生壁,次生壁。其中,初生壁中的纤维成网状,次生壁成平行脉络。其原纤维走向与植物细胞内的微管排布密切相关。
癌细胞的识别
癌细胞是引起癌症的罪魁祸首。癌细胞内部的微管组织系统受癌基因的不正常表达而发生巨大变化,其功能和作用也与癌变之前有较大差异。于是,在医学上可以根据微管系统的功能和形态来判断病人是否患有癌症。