2018年安徽高考化学模拟冲刺试题【含答案】
可能用到的相对原子质量:
7.下列说法错误的是
A.氧化钙用作儿童食品的干燥剂存在安全隐患
B.聚乙烯、聚氯乙烯、聚苯乙烯都是通过加聚反应制得的
C.雾霾天气对人的健康造成危害,“雾”和“霾”的分散质微粒不相同
D.绿色化学的核心是利用化学原理对环境污染进行治理
7.D A项儿童若将其误食或玩耍易造成灼伤;B项为乙烯、氯乙烯、苯乙烯等含有双键的物质进行不饱和键断裂加聚形成;C雾为液体颗粒分散质,而霾为固体颗粒分散质,所以正确;D项不应是污染了再治理,而应该是从源头上杜绝污染。
8.下列离子组一定能大量共存的是
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl-、SO42-
B.由水电离出c(H+)=10-3 mol·L-1的溶液中:Na+、AlO2-、NO3-、HCO3-
C.pH=12的溶液:K+、Na+、CH3COO-、Br-
D.无色溶液中可能大量存在Al3+、NH4+、Cl-、S2-
8.C A项硝酸将Fe2+氧化;B项HCO3在酸性、碱性条件下均不共存,且HCO3-与AlO2-不共存,产生Al(OH)3沉淀;D项Al3+、S2-双水解。
9.香花石被誉为“矿石熊猫”,由我国地质学家首次发现,它由前20号元素中的6种组成,其化学式为X3Y2(ZWR4)3T2,其中X、Y、Z为金属元素,Z的最外层电子数与次外层相等,X、Z位于同族,Y、Z、R、T位于同周期,R最外层电子数是次外层的3倍,T无正价,X与R原子序数之和是W的2倍。下列说法错误的是: ( )
A.原子半径:Y>Z>R>T B.气态氢化物的稳定性:W<R<T
C.最高价氧化物对应的水化物碱性:X>Z D.XR2、WR2两化合物中R的化合价相同
9.D 经推断X、Y、Z、W、R、T依次是:Ca、Li、Be、Si、O、F(尤其注意X和W的推断);A项原子半径:Li>Be>O>F正确;B项稳定性:SiH4<H2O<HF正确;C项最高价氧化物对应的水化物碱性:Ca(OH)2>Be(OH)2正确;D项CaO2、SiO2中R(即:O)的化合价分别为-1、-2。
10.利用下列装置进行相应实验,有关说法不正确的是 ( )

A.图1装置可验证酸性:H2CO3>H2SiO3
B.图2装置可用于收集气体:H2、Cl2、CO2、NH3
C.图3装置可用于分离CCl4萃取碘水后的有机层和水层
D.图4装置中接通开关后,Zn片腐蚀速率增大,Cu片上有气体放出
10.A A项盐酸挥发出的HCl也可以与Na2SiO3溶液反应;B项可以采用从不同的导管导入气体收集,C为分液;D项接通开关,构成原电池,加快了反应速率。
11.下列说法正确的是 ( )
A.按系统命名法,![]() 的名称为2,7,7-三甲基-3-乙基辛烷
的名称为2,7,7-三甲基-3-乙基辛烷
B.实验证实![]() 可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键
可使Br2/CCl4溶液褪色,说明该分子中存在独立的碳碳单键和碳碳双键
C.DDT的结构简式为![]() ,分子中最多有14个碳原子共平面
,分子中最多有14个碳原子共平面
D. 的单体是CH3-C≡C-CH3和CH2=CH-CN
的单体是CH3-C≡C-CH3和CH2=CH-CN
11.B A项名称为:2,2,7-三甲基-6-乙基辛烷;C项最多13个碳原子共平面;D项单体是CH2=CH-CH=CH2和CH2=CH-CN。
12.在下列装置中,MSO4和NSO4是两种常见金属的易溶盐。当K闭合时,SO42—从右到左通过交换膜移向M极,下列分析正确的是 ( )
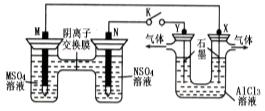
A.溶液中c(M2+)减小
B.N的电极反应式:N—2e—=N2+
C.X电极上有H2产生,发生还原反应
D.反应过程中Y电极周围生成白色胶状沉淀
12.C 左边构成了盐桥式原电池,由于,SO42—从右到左通过交换膜移向M极,说明M极附近产生了M2+,说明M做了负极,N极反应式为N2++2e—=N;X做了阴极,电极反应式为2H++2e—=H2↑,此极附近产生OH—与Al3+形成白色胶状Al(OH)3沉淀;Y做了阳极,电极反应式为:2Cl——2e—=Cl2↑,因此此题正确答案选C。
13.一定量CO2通入1 L某浓度的NaOH溶液得溶液A,向A溶液中逐滴滴入稀盐酸,加入n(HCl)与生成n(CO2)的关系如图所示。下列有关叙述不正确的是 ( )
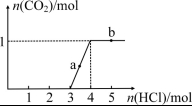
A.通入的CO2气体在标准状况下的体积约为22.4 L
B.图中a点溶液中:c(Na+) + c(H+)=c(HCO3-) + 2c(CO32-) + c(OH-)
C.没通入CO2之前NaOH溶液中c(NaOH)=4 mol/L
D.图中b点溶液中:c(H+)>![]()
13.B 由图纵坐标可知通入CO2应为1 mol,A正确;B中少c(Cl-)的浓度,B错误;由图可计算出原
NaOH总量为4 mol,C正确;b点表示HCl过量,溶液显酸性,D正确。
第Ⅱ卷(非选择题)
26.(14分)
I.在一个容积为2L的密闭容器中加人2mol N2和6mol H2,发生如下反应:N2(g) +3H2(g) ![]() 2NH3(g) ΔH<0。 5min 后达到平衡,测得c(NH3)=0.5mol/L。
2NH3(g) ΔH<0。 5min 后达到平衡,测得c(NH3)=0.5mol/L。
(1)![]() 该条件下此反应的化学平衡常数的表达式K=___________________________
该条件下此反应的化学平衡常数的表达式K=___________________________
(2)从反应开始到平衡,用H2的浓度变化表示的反应速率为:___________________。
(3)若平衡时,移走1molN2和3molH2,在相同温度下再达平衡时c( NH3 ) ________0.25mol/L(填“>”、“ <”或“=”)
II.250C,将0.4mol/L CH3COOH 溶液和 0.2mol/L NaOH 溶液各 100mL 混合后,pH =5(设混合后溶液总体积为两溶液体积之和)
(1)混合溶液中离子浓度由大到小的顺序是______________________________
(2)①c(CH3COO-) + c(CH3COOH)= _______ mol/L
② c(CH3COO-) —c(CH3COOH) =________mol/L
III.已知 250C 时Ksp[Fe(OH)3] =8×10-39,该温度下反应 Fe (OH)3+3H+![]() Fe3+ + 3H2O的平衡常数为_____________________________。(列 式 并 计 算)向0.001mol/L FeCl3溶液中通人氨气(体积变化忽略不计
Fe3+ + 3H2O的平衡常数为_____________________________。(列 式 并 计 算)向0.001mol/L FeCl3溶液中通人氨气(体积变化忽略不计![]() ),开始沉 淀 时 溶 液 的pH为________。(lg5 = 0.7)
),开始沉 淀 时 溶 液 的pH为________。(lg5 = 0.7)
26.(14分)I.(1)![]() (1分);(2)0.15mol·L-1·min-1(1分)(3)<(2分)
(1分);(2)0.15mol·L-1·min-1(1分)(3)<(2分)
II.(1)c(CH3COO—)>c(Na+)>c(H+)>c(OH—) (2分)(2)①0.2(2分);②2(10-5—10-9)或2×10-5(2分)
III.![]() (2分);2.3(2分)
(2分);2.3(2分)
27.(14分)
稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。硫、氮、稀土元素的单质和化合物应用广泛。
(1)将硫铁矿和焦炭按物质的量比3:2混合放在炼硫炉中,通入适量空气,恰好完全反应发生下列燃烧反应:
FeS2 + C + O2——→Fe3O4 + CO + S;
①请配平上述化学反应方程式____________________,生成3mol硫时,转移的电子的物质的量为___________。
②请写出FeS2的电子式________________________ 。
(2)过硫酸钾,化学式为:K2S2O8,过硫酸结构式为:
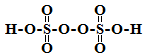
①过硫酸钾和过硫酸均有强氧化性,不稳定,容易分解,如2H2S2O8=2H2SO4+2SO3+O2
下列能加快过硫酸分解的固体物质是_________________________
A.CuO B.MnO2 C.Fe2O3 D.Na2SO4
②已知硫酸锰(MnSO4)和过硫酸钾两种盐溶液在催化剂存在下可发生氧化还原反应,生成高锰酸钾、硫酸钾和硫酸。请写出上述反应的化学方程式________________
③若该反应所用的硫酸锰改为氯化锰,当它跟过量的过硫酸钾反应时,除有高锰酸钾、硫酸钾、硫酸生成外,其他的氧化产物还有_____________________________
(3)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,由CeCl3·6H2O制备无水CeCl3应采取的措施是_______________________________
27.(每空2分,共14分)
(1)①3FeS2 + 2 C + 3O2 = Fe3O4 + 2CO + 6S ; 6mol ②![]()
(2)①A B C
②8H2O+2MnSO4+5K2S2O8 = 2KMnO4+4K2SO4+8H2SO4
③氯气
(3)在通入氯化氢气体的条件下加热除去结晶水
28.(15分)
某化学研究性学习小组设计实验探究铜的常见化学性质,过程设计如下:
【提出猜想】
猜想1:在元素周期表中,铜(IB族)与铝的位置很接近,铜不如铝活泼,氢氧化铝具有两性,氢氧化铜也具有两性。
猜想2:铁和铜都有变价,一般情况下,+2价铁的稳定性小于正三价的铁,则+1价铜的稳定性也小于+2价的铜。
猜想3:氧化铜具有氧化性,能被H2、CO还原,它也能被氮的某种气态氢化物还原。
【实验探究】
I.解决猜想1
(1)需用到的药品除1 mol · L-1CuSO4溶液、稀硫酸外还需__________________(填试剂的化学式)溶液。
(2)用胆矾晶体配制1 mol · L-1CuSO4溶液250mL,选用的仪器除烧杯、托盘天平、药匙、玻璃棒、胶头滴管外,还有_________________________(填仪器名称)。
(3)为达到实验目的,请你补全实验内容和步骤:
①用CuSO4溶液制备Cu(OH)2;②______________________________________________。
Ⅱ.解决猜想2
取一定量I中制备获得的氢氧化铜固体于坩埚中灼烧,当温度达到80~100℃得到黑色固体粉末;继续加热至1000℃以上,黑色粉末全部变成红色粉末氧化亚铜;取适量红色氧化亚铜粉末于洁净试管中,加入过量的稀硫酸(或盐酸),得到蓝色溶液,同时观察到试管底部还有红色固体存在。请根据以上实验现象回答问题:
(4)写出氧化亚铜与稀硫酸反应的离子方程式 。
(5)从实验Ⅱ可得出的结论是:在高温下+1价铜比+2价铜________(选填“稳定”或“不稳定”;下同);而溶液中+1价铜比+2价铜 。
Ⅲ.解决猜想3
设计如下装置(夹持装置未画出):
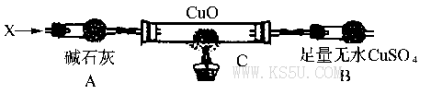
当氮的某种气态氢化物(X)缓缓通过灼热的氧化铜时,观察到氧化铜由黑色变成了红色,无水硫酸铜变成蓝色,生成物中还有一种无污染的单质气体Y;将X通人灼热的CuO燃烧管完全反应后,消耗0.01 mol X,测得B装置增重0.36g,最后收集到0.28g气体Y。
(6)仪器A的名称是_____________________。
(7)X的化学式为__________________________。
28.(15分;除标明外其余每空各2分)
I.(1)NaOH (2)250mL容量瓶(注:不写“250mL”不给分)
(3)将Cu(OH)2分别加入稀硫酸和稀NaOH溶液中,观察现象
Ⅱ.(4)Cu2O + 2H+ = Cu2++ Cu + H2O(5) 稳定 不稳定
Ⅲ.(6)(球形)干燥管(1分) (7)N2H4
36.[化学——选修2化学与技术](15分)
粉煤灰是燃煤电厂排出的主要固体废物。我国火电厂粉煤灰的主要氧化物组成为SiO2、Al2O3、CaO等。一种利用粉煤灰制取氧化铝的工艺流程如下:
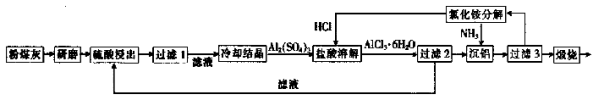
(1)粉煤灰研磨的目的是 。
(2)第1次过滤时滤渣的主要成分有 、 (填化学式,下同),第3次过滤时滤渣的成分是 。
(3)在104℃用硫酸浸取时,铝的浸取率与时间关系如图1,适宜的浸取时间为 h;铝的浸取率与![]() 的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在
的关系如图2所示,从浸取率角度考虑,三种助溶剂NH4F、KF及NH4F与KF的混合物,在![]() 相同时,浸取率最高的是 (填此助溶剂化学式);用该含氟的化合物作助溶剂的缺点是 (举一例)。
相同时,浸取率最高的是 (填此助溶剂化学式);用该含氟的化合物作助溶剂的缺点是 (举一例)。
 (4)流(4)过程中循环使用的物质有 (填化学式)。
(4)流(4)过程中循环使用的物质有 (填化学式)。
(5)用盐酸溶解硫酸铝晶体,再通入HCl气体,析出AlCl3· 6H2O,请简要说明该过程能够发生
的原因是 。
(6)用粉煤灰制取含铝化合物的主要意义是 。
36.(15分)(1)增大反应物的接触面积,提浸取速率和浸取率(2分)
(2)SiO2、CaSO4;Al(OH)3(各1分,共3分)
(3)2(1分);NH4F(1分);生产过程中会产生污染环境的HF和NH3(2分)
(4)H2SO4;NH4Cl(或NH3和HCl)(各1分,共2分)
(5)通入HCl使AlCl3·6H2O达到饱和,而Al2(SO4)3不饱和(2分)
(6)使废弃固体资源化利用(2分)
37.[化学——选修3物质结构与性质](15分)
钛和钛的合金已被广泛用于制造电讯器材、人造骨骼、化工设备、飞机等航天航空材料,被誉为“未来世界的金属”。请回答下列问题:
(1)钛有![]() 和
和![]() 两种原子,其基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于________区元素。
两种原子,其基态原子的电子排布式为 ;按电子排布Ti元素在元素周期表分区中属于________区元素。
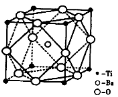
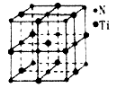
(2)偏钛酸钡在小型变压器、话筒和扩音器中都有应用。偏钛酸钡晶体中晶胞的结构如右图所示,它的化学式是________________。
(3)氮化钛(Ti3N4)为金黄色晶体,由于具有令人满意的仿金效果,越来越多地成为黄金装饰的替代品。以TiCl4为原料,经过一系列反应,可以制得Ti3N4和纳米TiO2。
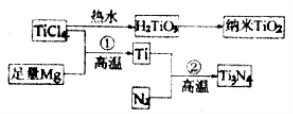
①TiCl4分子中4个氯原子不在同一平面上,则TiCl4的空间构型为________________。
②纳米TiO2是一种应用广泛的催化剂,纳米TiO2催化的一个实例如下:
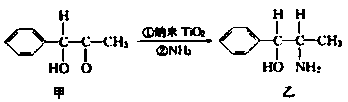
化合物甲的分子中采取sp2杂化的碳原子个数为________,化合物乙中采取sp3杂化的原子的第一电离能由大到小的顺序为________________。
③另有一种氮化钛晶体的晶胞如右图所示,该氮化钛晶胞中含有_____个N原子,晶胞中N、Ti之间的最近距离为a pm,则该氮化钛的密度为________g·cm-3(用NA表示阿伏加德罗常数的数值,只列算式)。
37(15分;除标明外其余每空各2分)
(1)1s22s22p63s23p63d24s2(或[Ar] 3d24s2)) d (1分)
(2)BaTiO3 (3)①正四面体
②7 ;N>O>C ③4 ;![]()
38.[化学-选修5有机化学基础](15分)
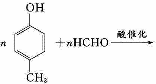
含氧有机物甲可用来制取多种有用的化工产品,合成路线如下:

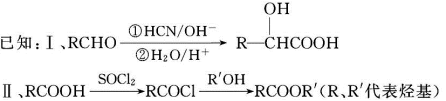
(1)甲的含氧官能团的名称是_____________________________________。写出检验该官能团常用的一种化学试剂的名称_______________________________________。
(2)写出己和丁的结构简式:己_____________________,丁_____________________。
(3)乙有多种同分异构体。属于甲酸酯,含酚羟基,且酚羟基与酯的结构在苯环邻位的同分异构体共有______种。
(4)在NaOH溶液中发生水解反应时,丁与辛消耗NaOH的物质的量之比为____________。
(5)庚与M合成高分子树脂的化学方程式为____________________________________。
38.(1)醛基 (2分) 新制银氨溶液(2分)
(2)(每空2分) ![]()
(3)5(2分) (4)1∶2(2分) (5)(3分)
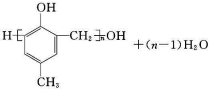
![]()