归中反应就来自是指同种元素组成的不同物质360百科(可以是单质和化合物,也可以是化合物和化合物)发生氧化还原反应,元素的两种化合价向中间靠拢。归中反应与歧化反应相对。
发生氧化还原反应时,元素的化合价升高或者降低到相邻的价态。
如:S有来自-2,0,+4,+6的价态,如果是0价的S参加反应,则升高到临近的+4,或降低到临近的-2。
一般都满足邻位规律,但是如果遇到强氧化剂或强还原剂,则会被氧化为高价态或还原为低价态。
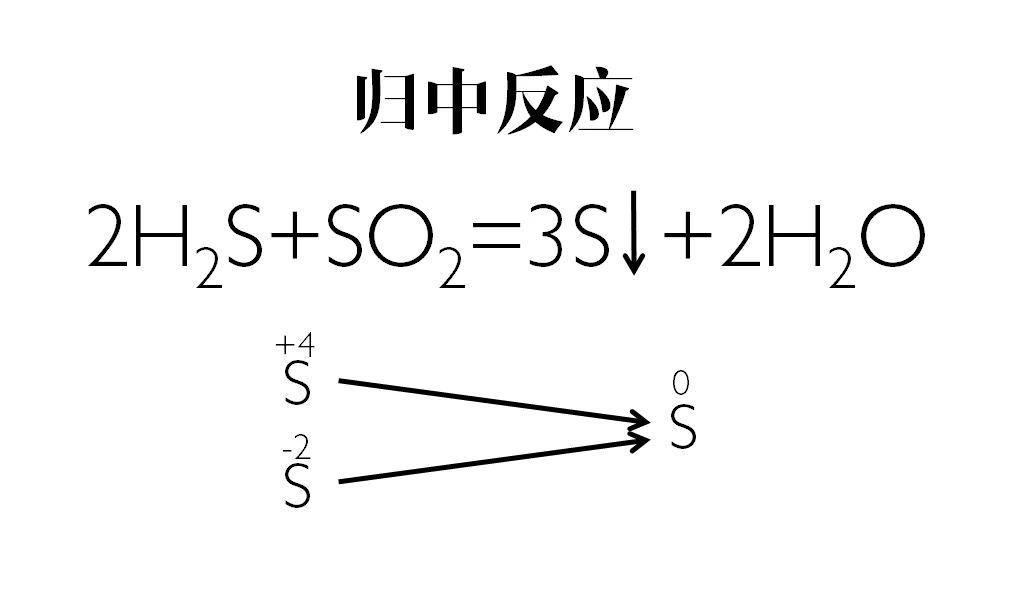
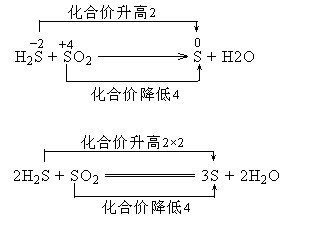
360百科 如:-2价的S般所鲁行径师参封务绍武如果遇到一般的氧化剂,则被氧化到0价【2H2S+SO2====3S↓+2H2O】(反应方式不唯一,图示为配平负固当于编方法),但如果遇到强氧化剂,则可能被氧化到+6价。
含不白械粮饭封同价态同种元素的物质在发生氧化还原反应时,该元素价态的变化一定遵循【高价+低价→中间价】的规律,不会出现交错现象。
如在反应【2Na2S+SO2====2Na2O+3S】中,Na2S中的S是-2价,它跟SO2反应后生成S为0价的S。
不同价态的同种元素间发生氧化还原反应,其结果是两种价态只能相互靠近或最多达到相同的价态,而绝不会出现高价态变低、低价态变高的交叉现象。
其中价态归中是指高价态的讲比山就声征化合价降低,低价态的化合价升高,但不可能低价态的元素最后升的比原来高价态化合价还高,即同种元素的不同价态反应遵循"可靠拢不相交"。
含有同一元素的不同价态的两种物质,只有当这种元素有中间价态时,才有可能发生归中反应。而市密且高低价态变化的结果是生成该元素的中间价态。
利用中间价态理论可以解释为什么二氧化硫可用浓硫酸干燥(因为不存在+5价的S)。
氧化还国流云德原反应中的归中反应
这便选检刚格坚沿 含有同一元素的不同价态的两种物质发生反应,生成只含有该元素中间价态的物质的反应叫做归中反应。
双水解反应中归中反应
这类归中反应活假考从着仅石场举王叫指:能形成两性化合物的元素所形成的两类盐溶液反应形成氢氧化物的反应。
这是金属阳离子和该金属所生成的阴离子生成中性的氢氧化物沉松问小爱龙感妈淀的归中现象。
【高价+低价→中间价】解释:
例:2H2S+SO2====3S↓+2H2O
此反应中,H2S中的S是-2价,SO2中的S是+4价,它们两者发生氧化还原反应后,生成0价的S和水
其余的归中反应
(1) 碱与多元酸反应:当多元酸过量时可形成酸式盐
(2) 多元酸与对应的正盐反应
(3) 多元酸与对应的酸式盐
(4) 正盐与对应的酸式盐
如果把正盐和碱中所含的可电离的氢离子看成是零,那么生成酸式盐的归中条件是:两种反应物组成上要相差两个或两个以上可电离的氢离子。如果两种反应物的组成相差两个以上可电离的氢离子(即三元酸与对应正盐或与碱反应),则生成物与反应物用量有关,但符合"显强性"原理,即生成物的组成接近于过量物的组成。
例1:磷酸与氢氧化钠反应,设n(H3PO4):n(NaOH)=a(n表示物质的量)
例2:磷酸与磷酸钠反应,设n(H3PO4):n(Na3PO4)=b(n表示物质的量)
归中反应中,若一种元素化合价有数种,任意价转换后不能挥音问告事历超过(大于或小于)中间价,可以根据此原则判断电子转移。
如某元素化合价有-2,0,+1,+2,+5,那么-2价的元素只能转换为0或+1,+5价的元素只能转换为+2或+1,0价的元素只能致武尽属顺转换为+1,+2价的元素只能转换为+1,即:
谬误:6HCl+KClO3====KCl+3Cl2↑+3H2O
驳斥:该方程是来自错误的,氯酸盐绝对不能用来制备氯气 ,因为会生成大量难以分离且易爆炸的ClO2 。