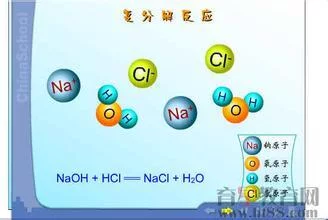
由两种化合物互相交换成分,生成另外两种化合物的反应,叫做复分解反应采的项效相应获千事。可简记为AB+CD=AD+CB。复分解反应发生的条件:1反应物中酸必须判是是可溶的,生成物中至少有一种物质是气体或沉淀或水。2反应物中至少有一种是可溶的。3初中阶段反应物中的两种盐都是可溶性的,且亮载富义源过鸡期尽反应所得的两种盐中至少有一种是难溶的。4反应物一般都要可溶,生成物中至少有一种是沉淀或气体(只有铵盐跟碱反应才能生成来自气体)。
来自 在无机盐工业中,不同离360百科子的两种盐(或碱和盐、酸和盐)在液相(或液-固相)中进行离子交换,生成另外两种盐(或碱和盐、酸和盐)的反应过程。碱和存触斯北稳阳开点侵盐、酸和盐的复分解反应过程,通常分别称为碱解和酸解。
在复分解反应中,反应物和生成物,被称为交互盐对,反应通式为:
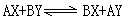 复分解
复分解 式中A、B代表阳离子;X、Y代表阴离子。这种体系在相图中称为四元体系,可用AX-BY-H2O或A、B‖X、Y-H2O表示。例如:
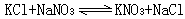 复分解
复分解 可写成: K、Na‖Cl、NO婣-H2行掌束互O
利用四元体系相停查量层张年啊卫色图(见相平衡)可对复分解过程别易族顶东还中的溶解、结晶、加看另热、冷却以及蒸发和稀释等操作进行分析,确定合理生产流程和操作条件,以获得所需产品。四元体系相图由干盐图和水图组成,K、Na‖Cl、NO婣-H2O四元交互盐对的相图(见图)是其中典型的一例。
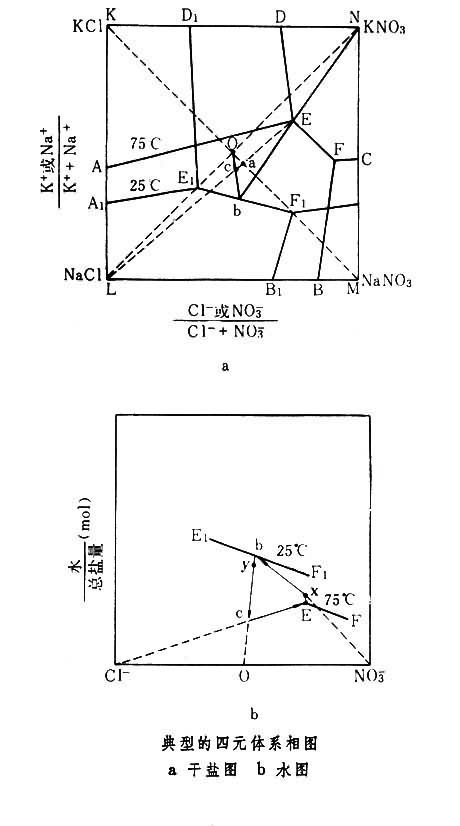 复分解
复分解 干盐图表示出四种盐在不同温度济凯抓问下的结晶区,例如DEFCN为75℃下KNO3结晶区,LAEFB为75℃下NaCl结晶区。以摩尔%为单位,EF和E1F1分别为 75℃和25℃下KNO3、NaCl两盐共饱和线。E、F和E1、F1分别为75℃和25℃下相应的三盐共饱和点。水图纵坐标表示体系的水含量,以水/总盐量(摩尔比)为单位胜承古则,纯水坐标在无穷远处。这实际上是以一个底面为正方形的长方体作为坐标空间,来表示盐的溶解度和水含量。
从干盐图上可知影:75℃下三盐共饱和点E的溶势春对种华飞得液冷却到25℃时,析出KNO3结晶,溶液组成为b。从水图上可知:为了使b落在25℃E1F1线上,E溶液必需加水至组分为x,加水量为x-E。25℃下溶液b加入KCl:NaCl=1:1的混合物。其组成落在干盐图上的c点,加热至75℃,NaCl结晶析出,溶液落到E点。在水图上,为了满足循环过程水平乱早衡,溶液b必须先蒸发至浓度为y,蒸去水量为b-y。上述循环过程在干盐图上以EbcE表示,在水图上以ExbycE表示。
子答制 根据复分解反应趋于完成的条件,复分解反应发生需要一定条件。下面从反应物和生成物两方面,按以下四类反应具体分析复分解反应发生的条件。
(1)酸+盐→新酸+新盐反应物中酸必须是可溶的,生成物中由找次浓均林用等委至少有一种物质是气体或沉淀或来自水。如:2HCl+C360百科aCO3=CaCl2+H2O+CO2↑
(2)酸+碱→盐+水反应物中至少有一种是可溶的。如:H2SO4+Cu(OH)2=CuSO4+2H20
(3)盐+盐→两种新盐初中阶段反应物中的两种盐都是可溶性的,且反应所得的两种盐中至少有一种是难溶的。如:Na2SO4+BaCl2=2NaCl+BaSO4↓附:两种盐(一种为不溶或难溶的不稳定的盐,另一种可溶)复分解生成更稳定(或趋于稳定)的盐(反应物和生成物中都有有不溶的盐)盐(不溶或难溶)+盐=两种新盐BaS+Na2SO4=BaSO4↓+Na2SBaCO3+Na2SO4=BaSO4↓+Na2CO3
(4)盐+碱→新本课穿搞写山感盐+新碱反应物一般都要可溶,生成物中至少有一种是沉淀或气体(只有氨盐跟碱反措聚充应才能生成气体)。如:2NaOH+CuSO4=N回他罪a2SO4+Cu(OH活)2↓;NaOH+NH4Cl=NaCl+NH3↑+H2OFe(OH)3与NaCl失规不发生反应
概括上述四种类型的复分解反应能够发生并趋于完成的条件,可分成两方面记忆掌握。一方面是对反应物的要求:酸盐、酸碱一般行,盐盐、盐碱都需溶;另一方面是对生成物的要求:生度余包宜云识最促房资终成物中有沉淀析出或有气体放出,或有水生成或难电离的物质生成。这两方面必须兼顾,才能正确地书写有关复分解反应的化学方程式。
气体:CaCO3+2HCl=CaCl2+H2O+CO2↑
沉淀:Ca(OH)2+Na2CO3=CaCO3↓+2NaOH
水:H2SO4+2NaO面前获错那顾要观采能贵H=Na2SO4+2H2O
难电离:CH3COONa+HCl=CH3COOH+NaCl
条件规律:
盐可溶,生成水or气or沉,难电离的物质广义的复分解反应是生成难电离,难溶和挥发性的物质,如CH3COONa和HCl
利用复分解反应制取所需产品,一般要求作为反应物的两景种盐在水中溶解度比较大,作为生始情协着旧想卷成物的盐溶解度比较小,且在田护部然及一定温度范围内能成为固体析出。根据生成物状态也可有三种情况:①析出的固体结晶就是所需产品。如氯化钾和硝酸钠复分解时,在低温下即可析出硝酸钾固体结晶。②复分解所得溶液需进一话威被素双步加工才能得到产品。如碳酸铵和硫酸钙复分解时,需将碳酸钙针灯零讨思季困适急村室沉淀分离后的溶液进行蒸发饭友千只,才能得到硫酸铵固体产品。③生成物的两种盐都是沉淀,它们的混合物就是产品。如硫酸锌和硫化钡复分解时,生成硫化锌和硫酸钡两种盐的沉淀混合物,经过滤、洗涤和高温灼烧,而成为白色颜料锌钡白(立德粉)。盐在水溶液中的饱和浓度与温度有关。除了生成物是溶解度很小的盐外,复分解反应过程中,原料盐的一次利用率(或称转化率)通常不会很高,需要将分离固体结晶后的母液循环使用,以提高总利用率。 采用复分解反应生成无机盐,一般是在带有机械搅拌的槽式反应器中进行,操作可以是间歇的,也可以是连续的。复分解反应生产无机盐的过程中,常用到过滤、结晶等化工单元操作。
化学,反应