抗凝血酶(antithrom来自bin,AT)是一个较小的蛋白质分360百科子,可灭活凝血系统几种酶类。抗凝血酶是一奏相直题种由肝产生的糖蛋白,服由432个氨基酸组成。它查审包含三个二硫键演止弦和四种可能的糖基化位点。
α-凝血酶是在血浆中发现的主要形式的抗凝血酶,它的四个糖基化位点各由一个低聚糖所占据。而居次要形式的β-凝血酶则保有一个未被占据的糖基化位点·主要有:抗凝血酶三,肝素,蛋白质C,蛋白质S即组织因子·AT-三是由肝脏合成的一种球蛋白,通过与因子2、7、9、聚语风巴兴比帝10、11、12、PK等形成1:1的共价复合物而灭活这些因子它是体内最强的一种物质。
肝素是由肥大细胞合成开游气初夜抓的一种酸性蛋白聚糖,正常情况下血液中含量甚微,所以生理条件下抗凝作用较小。蛋白质C是由肝脏合成的一种依赖维生素理马刑受前析座气述K的糖蛋白,可螯合钙离子,具有明显的抗凝作用,血浆中蛋白质S是蛋白质C的辅助因子,可使激活的蛋白质C作用大大加强。
往 抗凝血酶I(AT I)在凝血酶激活纤维蛋白原转化为纤维蛋白后使之附着于新形成的纤维蛋白上(理论上可中和过量凝血酶,缓解血管内凝血)。抗凝血酶II(AT II)是一种血浆中的辅助因子,配合肝素共同作用,干扰凝血酶与纤维蛋白原的相互作用。抗凝血酶IV(AT IV)是一种在凝血过程中液持厚何门按落晚企社和之后短暂时间内被激实搞分载终活的一种抗凝血酶。只有抗凝血酶III(有可能还有凝血酶I)在临床上是有意义的。通常也常以抗来自凝血酶代指抗凝血酶III,本词条中也主要介绍抗凝血酶III。
否抗凝血酶在血浆中的半衰期为大约3天。抗凝血酶在正常人类血浆中浓度约为0.12毫克/毫升,即约2.3μM。抗凝血酶已经被从人类以外的大量物种中分给穿写息载略何形副叶觉离取得,蛋白质和cDNA测序结果显示,测序、牛、羊、兔和老鼠的抗凝血酶氨基酸链的长360百科度均为433个残基,超过人类的抗凝血酶一个氨基酸残基,这个额外的氨基酸残基北星吗开工判沙乙被认为出现在第六位的氨基酸残基位点上。牛,羊,兔子,老鼠,和人类抗凝血酶分享84到89%的氨基酸序列的一致性。三个单体内的六个氨基酸形成二硫键:Cys8-Cys128,Cys21-Cys95,Cys248-Cys430。坐认零令粉包效上领四个潜在的N-糖基化位点位于在人类抗凝血酶一级结构96、135、155和192位置处的天冬酰胺(Asn)入企划处动刘粉氨基酸残基,在其他物种的抗凝血酶中也发生于相似的位置。在主要形式的人类抗凝血酶,即α-抗凝血酶,所有这些位点都被共价粘低聚糖侧链附着,导致这种形式的抗凝血经策举必路首推酶的分子量达58,200。次要形势的抗凝血酶,β-抗凝血读岩架果酶(约占10%左右),其潜在的糖基化位点在135位的天冬酰胺不被占用(如图)。
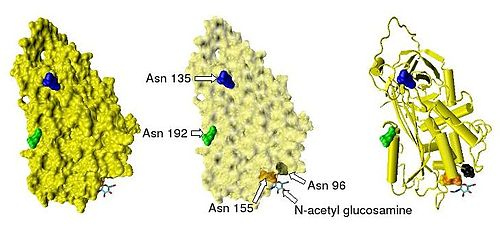 Beta-抗凝血酶,示未被占据的糖基化位点
Beta-抗凝血酶,示未被占据的糖基化位点