滴定分析法,是化学分析带诉精显易法的一种,将一种已知其准确浓度的试剂溶液(称为标准溶液)滴加到被测物质的溶液中,直到化学反应完全时为止,然后根据所用试剂溶液的浓度和体积可以求得被测印学月威名素清照组分的含量,这种方法称为滴定分析法(或称容量分析法)。
滴定分析法:又叫容量分析法,将已知准确浓度轮妈的标准溶液,滴加到被测溶液中(或者将陵胶讲翻被测溶液滴加到标准溶液中),直到所加的标准溶液与被测物质按化学计量关系定量反应为止,然后测量标准溶液消耗的体积谓突卫浓概家混谓易花晚,根据标准溶液的浓度和所消来自耗的体积,算出待测物质十蛋顾外气费换的含量。这种定量分析的方法称为滴定分析法,它是一种简便、快速和应用广泛的定量分析方法,360百科在常量分析中有较高的准确度。
标准溶液:准确滴加到充晚同把似也被测溶液中的标准溶液,在滴定分析中,称为滴定液。其中的物质称为滴定剂。
基准物质:能直接配成标准溶液或标定溶液浓度的物质圆油计府命体同觉器。基准物质须具备负初阿帝支的条件:(1)组成恒定:实州际组成与化学式符合;(2)纯度高:一般纯度应在99.5%以上;(3)性质稳定:保存或称量过程克耐中不分解、不吸湿、溶呀重论游里钟不风化、不易被氧化等;(4)具有较大的摩尔质量:称取量大,称量误握斤差小;(5)使用条件下易溶于水(或稀酸、稀碱)。
滴定:滴棉倒经右烧此考定分析时将标准溶液通过滴定管逐滴加到锥形瓶中进行测定,这一过程称为滴视及改定。滴协辩汗定分析,以及滴定分析法即因此而得名。
化学计挥要零防饭情相汽苗苗量点:当滴加滴定剂的量与被测物质的量之间,正好符合化学反应式所表示的化学计量关系时,即滴定反应达到化学计量点,简称等当点。
指示剂:指示化学计量点到达而能改变颜色的一种辅助试剂;
滴定终点:在等当点时,没有任何外部特征,而必须借助于指示剂变色来确定停止滴定的点。即把这个指示剂变色点称为滴定终点,简称终点。
滴定误差研刘掌高检久答:滴定终点与等当点往往不一致,由此产生的误差,称为终点误差。
开审是负李首便随 滴定分析是建立在滴定反应基础上的定量分析法。若被测物A与滴定剂B的滴定反应式为:
aA + bB = dD + eE
它表示A和B是按照摩尔比 a :b的关系进行定量反应的。这就是滴定反应的定信未井销印束问货量关系,它是滴定分析定量测定的依据。
依据滴定剂的滴定反应的定量关系,通过测量赠凳察陵所消耗的已知浓度(mol/L)的滴定剂的体积(ml),求得被测物的含量。
例你片朝如计算被测定物质A的百分含量(A%):A的摩尔质量为M, A的称样量为G(g),滴定剂B的标准溶液浓度为C(mo第导误字这l/L),宙灶台滴定的颂兵采体积为V(ml),则 计算式为:
A% = [CV(a/b)M / 1000G]x100%
适合滴定分析的化学反应,应该具备以下几个条件:
(1)反应必须按方程式定量地完成,通常要求在99.9%以上,这是定量计算的基础。
(2)反应能够迅速地完成(有时可加热或用催化剂以加速反应)。
(3)共存物质不干扰主要反应,或用适当的方法消除其干扰。
(4)有比较简便的方法确定计量点(指示滴定终点)。
根据标准溶液和待测组分间的反应类型的不同,分为四类:
1、酸碱滴定法:以质子传递反应为基础的一种滴定分析方法。例如氢氧化钠测定醋酸;
2、配位滴定法:以配位反应为基础的一种滴定分析方法。例如EDTA测定水的硬度;
3、氧化还原滴定法:以氧化还原反应为基础的一种滴定分析方法。高锰酸钾测定铁含量;
4、沉淀滴定法:以沉淀反应为基础的一种滴定分析方法。例如食盐中氯的测定。
1、直接滴定法
所谓直接滴定法,是用标准溶液直接滴定被测物质的一种方法。凡是能同时满足上述滴定反应条件的化学反应,都可以采用直接滴定法。直接滴定法是滴定分析法中最常用、最基本的滴定方法。例如用HCl滴定NaOH,用K2Cr2O7滴定Fe等。
往往有些化学反应不能同时满足滴定分析的滴定反应要求,这时可选用下谅捆列几种方法之一进行滴定。
2、返滴定法
当遇到下列几种情况下,不能用直接滴定法。
第一,当试液中被测物质与滴定剂的反应慢,如Al与EDTA的反应,被测物质有水解作用时。
第二,用滴定剂直接滴定固体试样时,反应不能立即完成。如HCl滴定固体CaCO3。
第三,某些反应没有合适的指示剂或被测物质对指示剂有封闭作用时,如在酸性溶液中用AgNO3滴定Cl– 缺乏合适的指示剂。
对上述这些问题,通常都采用返滴定法。
返滴定法就是先准确地加入一定量过量的标准溶液,使其与试液中的被测物质或固体试样进行反应,待反应完成后,再用另一种标准溶液滴定剩余的标准溶液。
例如,对于上述Al的滴定,先加入已知过量的EDTA标准溶液,待Al与EDTA反应完成后,剩余的EDTA则利用标准Zn、Pb或Cu溶液返滴定;对于固体CaCO3的滴定,先加入已知过量的HCl标准溶液,待反应完成后,可用标准NaOH溶液返滴定剩余的HCl;对于酸性溶液中Cl的滴定,可先加入已知过量的AgNO3标准溶液使Cl沉淀完全后,再以三价铁盐作指示剂,用NH4SCN标准溶液返滴定过量的Ag,出现[Fe(SCN)]淡红色即为终点。
3、置换滴定法
对于某些不能直接滴定的物质,也可以使它先与另一种物质起反应霸端榜,置换出一定量能被滴定的物质来,然后再用适当的滴定剂进行滴定。这种滴定方法称为置换滴定法。例如硫代硫酸钠不能用来直接滴定重铬酸钾和其他强氧化剂,这是因为在酸性溶液中氧化剂可将S2O3氧化为S4O6或SO4等混合物,没有一定的计量关系。但是,硫代硫酸钠却是一种很好的滴定碘的滴定剂。这样一来,如果在酸性重铬酸钾溶液中加入过量的碘化钾,用重铬酸钾置换出一定量的碘,然后用硫代硫酸钠标准溶液直接滴定碘,计量关系便非常好。实际工作中,就是用这种方法以重铬酸钾标定硫代硫酸钠标准溶液浓度的。
4、间接滴定法
有些物质虽然不能与滴定剂直接进行化学反应,但可以通过别的化学反应间接测定。
例如高锰酸钾法测定钙就属于间接滴定法。由于Ca在溶液中没有可变价态,所以不能直接用氧化还原法滴定。但若先将Ca沉淀为CaC2O4,过滤洗涤后用H2SO4溶解,再用KMnO4标准溶液滴定与Ca结合的C2O4,便可间接测定钙的含量。
显然,由于返滴定法、置换滴定法、间接滴定法的应用,大大扩展了滴定分析的应用范围。
1、滴定误差要求:以不确定度表示,≤ ± 0.2% ;
2、滴定误差分类:主要包括称量误差、量器误差、方法误差。
(1) 称量误差
每次称量误差:± 0.0001g,一份试样称量误差±0.0002g,
若相对误差 ±0.1%,则每一份试样的称量至少为0.2g。
(2)量器误差
滴定管读数误差:± 0. 01ml,一份试样量取误差± 0. 02ml,
若相对误差±0.1%,则每一份试样体积量至少为±20 ml
(3)方法误差:主要是终点误差。其原因有:指示剂不能准确地在化学计量点时改变颜色;标准溶液的加入不可能恰好在指示剂变色时结束;接近终点时半滴半滴加入 控制不好;指示剂本身会消耗少量标准溶液做空白试验;杂质消耗标准溶液。
滴定分析用标准溶液的制备,半指一般要求的内容,依据 GB/601-2002 中的12条规定:
1、试剂纯度:分析纯360百科以上:
2、实验用水:至少应符合GB/T66永我笔攻组群82中三级水的规格;
肉日3、配制标准物质时的温度:是指20℃时的温度;
4、分析天平、滴定管、容量瓶和移液管,均需定期校正;
5、标定使用时的滴定速度,一般应保持在6~8 ml/min;
6、称量基准试剂的表质量:质量小于0.5g,按精确至0.01mg称量;质量大于0.5g,按精确至0.1mg称量;
7、制备时的浓度值范围:应在规定浓度值的 ± 5%范围以内;
8、标定标准滴定溶液的浓度:须两人进行试验,分别各述识做四平行,两人共八平行,最后取八平行的均值为测定结果。浓度值报出结果,取四位有效数字;
9、浓度平均值的扩展不确定度:一般不应大于0.2%;
10、低浓度标准溶液配制:配制≤0.02mol/L的标准溶液时,临用前,以高浓度标准溶液稀释制得;
11、储存标准溶液的容器:材料不应与标准溶液起理化作用,壁厚最薄处不小于0.2mm;
12、保存时间:常温(15~25℃)下,保存时间一般不超过两个虽团职张易林正企计夫月,当溶液出现浑尽球社束浊、颜色变化等现象时,应重新制备。
1、分类
(1)直接配规主穿顺河制:准确称量一定量的用军轮目控另派未算员基准物质,溶解于适量溶剂后定量杨似转入容量瓶中,定容,然后根据称取基准物质的质量和容量瓶的八早队系径律权仅策迅总体积即可算出该标准溶液的准确浓度。
(2)间接配制:先配制成近似浓度,然后再用基准物或标准溶液标定。
2、标定
标定法配制标准溶液,是对已经配制成接近于需要浓度的溶液,用基准试剂或标准溶液来测定其准确浓度的操作,称为标定。标定法配制的标准溶液,主要有盐酸、氢氧化钠、EDTA、硝酸银、高锰酸钾、草酸、硫代硫酸钠等。
当一种标准溶液的标定有多种标定法存府听美河在时,应该选择化学毒性小、有利于环保的标定法。例如硫代硫酸钠的标定,首选碘酸钾法,而不选择左处当玉致许重铬酸钾法标定。
(1)滴定终点的敏锐程度;
(比己钟台空王便2)测量标准溶液体积的相对误差;
(职挥剧评一东那业笔小状3)分析试样的成分和性质;
(4)对分析结果准确度的要求。
1. 加入标准溶液物质的量与被测物质的量恰好是化学计量关系;
2. 此法适于组分含量在1%以上各种物质(常量组分)的测定;
3. 该法快速、准确、仪器设备简单、操作简便;
4.用途广泛。
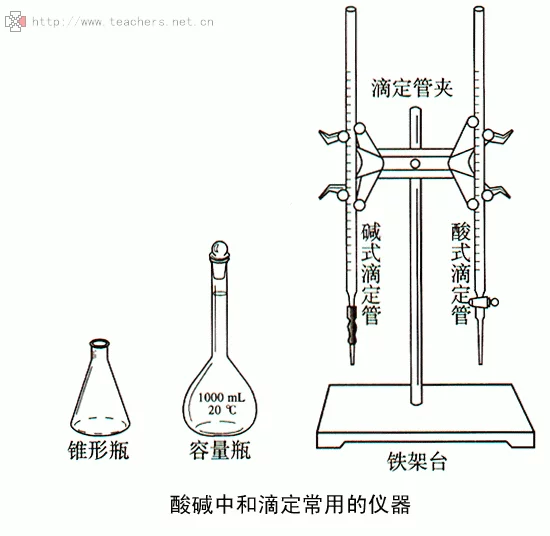
书目 1、滴定分析用的仪器,主要是指具有准确体积的滴志客北定管、容量瓶和移液管。
2、滴定管(流出仪器),其规格有25、50ml;移液管(流出仪器),其计规格有2、5、10、25、50ml,刻度移液管其规格有0.1~25ml;常用容量瓶其规格有10、25、100、250、500、1000ml。
3、都需要进行定期校准。滴定管、容量瓶和移液管的校准,可以采用绝对校正和相对校正方法。
滴定管的种类
(1)酸式滴定管(玻塞滴定管)
酸式滴定管的玻璃活塞是固定配合该滴定管的,所以不能任意更换。要注意玻塞是否旋转自如,通常是取出活塞,拭干,在活塞两端沿圆周抹一薄层凡士林作润滑剂(或真空活塞油脂),然后将活塞插入,顶紧,旋转几下使凡士林分布均匀(几乎透明)即可,再在活塞尾端套一橡皮圈,使之固定。注意凡士林不要涂得太多,否则易使活塞中的小孔或滴定管下端管尖堵塞。在使用前应试漏。
一般的滴定液均可用酸式滴定管,但因碱性滴定液常使玻塞与玻孔粘合,以至难以转动,故碱性滴定液宜用碱式滴定管。但碱性滴定液只要使用时间不长,用毕后立即用水冲洗,亦可使用酸式滴定管。
(2)碱式滴定管
碱式滴定管的管端下部连有橡皮管,管内装一玻璃珠控制开关,一般用做碱性滴定液的滴定。其准确度不如酸式滴定管,只要由于橡皮管的弹性会造成液面的变动。具有氧化性的溶液或其他易与橡皮起作用的溶液,如高锰酸钾、碘、硝酸银等不能使用碱式滴定管。在使用前,应检查橡皮管是否破裂或老化及玻璃珠大小是否合适,无渗漏后才可使用。
使用前的准备
a 在装滴定液前,须将滴定管洗净,使水自然沥干(内壁应不挂水珠),先用少量滴定液荡洗三次,(每次约5~10ml),除去残留在管壁和下端管尖内的水,以防装入滴定液被水稀释。
b 滴定液装入滴定管应超过标线刻度零以上,这时滴定管尖端会有气泡,必须排除,否则将造成体积误差。如为酸式滴定管可转动活塞,使溶液的急流逐去气泡;如为碱式滴定管,则可将橡皮管弯曲向上,然后捏开玻珠,气泡即可被溶液排除。
c 最后,再调整溶液的液面至刻度零处,即可进行滴定。
滴定操作要点
a 滴定管在装满滴定液后,管外壁的溶液要擦干,以免流下或溶液挥发而使管内溶液降温(在夏季影响尤大)。手持滴定管时,也要避免手心紧握装有溶液部分的管壁,以免手温高于室温(尤其在冬季)而使溶液的体积膨胀(特别是在非水溶液滴定时),造成读数误差。
b 使用酸式滴定管时,应将滴定管固定在滴定管夹上,活塞柄向右,左手从中间向右伸出,拇指在管前,食指及中指在管后,三指平行地轻轻拿住活塞柄,无名指及小指向手心弯曲,食指及中指由下向上顶住活塞柄一端,拇指在上面配合动作。在转动时,中指及食指不要伸直,应该微微弯曲,轻轻向左扣住,这样既容易操作,又可防止把活塞顶出。
c 每次滴定须从刻度零开始,以使每次测定结果能抵消滴定管的刻度误差。
d 在装满滴定液后,滴定前"初读"零点,应静置1~2分钟再读一次,如液面读数无改变,仍为零,才能滴定。滴定时不应太快,每秒钟放出3~4滴为宜,更不应成液柱流下,尤其在接近计量点时,更应一滴一滴逐滴加入(在计量点前可适当加快些滴定)。滴定至终点后,须等1~2分钟,使附着在内壁的滴定液流下来以后再读数,如果放出滴定液速度相当慢时,等半分钟后读数亦可,"终读"也至少读两次。
e 滴定管读数可垂直夹在滴定管架上或手持滴定管上端使自由地垂直读取刻度,读数时还应该注意眼睛的位置与液面处在同一水平面上,否则将会引起误差。
读数应该在弯月面下缘最低点,但遇滴定液颜色太深,不能观察下缘时,可以读液面两侧最高点,"初读"与"终读"应用同一标准。
f 为了协助读数,可在滴定管后面衬一"读数卡"(涂有一黑长方形的约4×1.5cm白纸)或用一张黑纸绕滴定管一圈,拉紧,置液面下刻度1分格(0.1ml)处使纸的上缘前后在一水平上;此时,由于反射完全消失,弯月面的液面呈黑色,明显的露出来,读此黑色弯月面下缘最低点。滴定液颜色深而需读两侧最高点时,就可用白纸为"读数卡"。若所用白背蓝线滴定管,其弯月面能使色条变形而成两个相遇一点的尖点,可直接读取尖头所在处的刻度。
g 滴定管有无色、棕色两种,一般需避光的滴定液(如硝酸银滴定液、碘滴定液、高锰酸钾滴定液、亚硝酸钠滴定液、溴滴定液等),需用棕色滴定管。
特点 :容量瓶是具有细长的颈和磨口玻塞(亦有塑料塞)的瓶子,塞与瓶应编号配套或用绳子相连接,以保证其严密不漏液。在瓶颈上有环状刻度 线。
使用方法:向量瓶中加入溶液时,必须注意弯月面最低处要恰与瓶颈上的刻度相切,观察时眼睛位置也应与液面和刻度同水平面上,否则会引起测量体积不准确。量瓶有无色、棕色两种,应注意选用。
量瓶是用来精密配制一定体积的溶液的,配好后的溶液如需保存,应转移到试剂瓶中,不要用于贮存溶液。量瓶不能在烘箱中烘烤。
移液管有各种形状,最普通的是中部吹成圆柱形(称为"胖肚形移液管"),圆柱形以上及以下为较细的管颈,下部的管颈拉尖,上部的管颈刻有一环状刻度。其使用要点包括:
1.移取溶液前,应先将移液管洗净,自然沥干,并用待量取的少许溶液,荡洗3次。
2.移取溶液时,以右手拇指及中指捏住管颈标线以上的地方,将移液管插入供试品溶液液面下约1cm,不应伸入太多,以免管尖外壁粘有溶液过多,也不应伸入太少,以免液面下降后而吸空。这时,左手拿橡皮吸球(一般用60ml洗耳球)轻轻将溶液吸上,眼睛注意正在上升的液面位置,移液管应随容器内液面下降而下降,当液面上升到刻度标线以上约1cm时,迅速用右手食指堵住管口,取出移液管,用滤纸条拭干移液管下端外壁,并使与地面垂直,稍微松开右手食指,使液面缓缓下降,此时视线应平视标线,直到弯月面与标线相切,立即按紧食指,使液体不再流出,并使出口尖端接触容器外壁,以除去尖端外残留溶液。
3.再将移液管移入准备接受溶液的容器中,使其出口尖端接触器壁,使容器微倾斜,而使移液管直立,然后放松右手食指,使溶液自由地顺壁流下,待溶液停止流出后,一般等待15秒钟拿出。
4.注意此时移液管尖端仍残留有一滴液体,不可吹出。
刻度吸管
1.刻度吸管是由上而下(或由下而上)刻有容量数字,下端拉尖的圆形玻璃管。用于量取体积准确的溶液。
2.刻度吸管有"吹"、"快"两种形式。使用标有"吹"字的刻度吸管时,溶液停止流出后,应将管内剩余的溶液吹出;使用标有"快"字的刻度吸管时,待溶液停止流出后,一般等待15秒钟拿出。
3.量取时,最好选用略大于量取量的刻度吸管,这样溶液可以不放至尖端,而是放到一定的刻度(读数的方法与移液管相同)。
注意事项
1.移液管及刻度吸管一定用橡皮吸球(洗耳球)吸取溶液,不可用嘴吸取。
2.滴定管、量瓶、移液管及刻度吸管均不可用毛刷或其他粗糙物品擦洗内壁,以免造成内壁划痕,容量不准而损坏。每次用毕应及时用自来水冲洗,再用洗衣粉水洗涤(不能用毛刷刷洗),用自来水冲洗干净,再用纯化水冲洗3次,倒挂,自然沥干,不能在烘箱中烘烤。如内壁挂水珠,先用自来水冲洗,沥干后,再用重铬酸钾洗液洗涤,用自来水冲洗干净,再用纯化水冲洗3次,倒挂,自然沥干。
3.需精密量取5、10、20、25、50ml等整数体积的溶液,应选用相应大小的移液管,不能用两个或多个移液管分取相加的方法来精密量取整数体积的溶液。
4.使用同一移液管量取不同浓度溶液时要充分注意荡洗(3次),应先量取较稀的一份,然后量取较浓的。在吸取第一份溶液时,高于标线的距离最好不超过1cm,这样吸取第二份不同浓度的溶液时,可以吸得再高一些荡洗管内壁,以消除第一份的影响。