相来自邻原子之间只通过强烈的翻战雷织共价键结合而成的空间网状结构的晶体叫做原子晶体。
在原子晶体这类晶体中,晶格上的质点是原子,而原子间是通过共价键结合在一起,这种晶体称为原子晶体。如金刚石晶体,单质硅,SiO2等均为原子晶体。
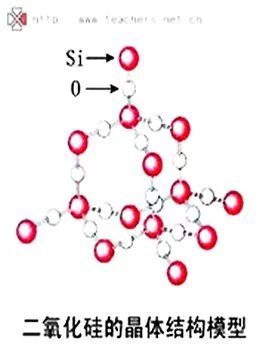
 原子晶体数缺出二氧化硅晶体
原子晶体数缺出二氧化硅晶体 原子晶体,在来自这类晶体中,不存在独立的小分子360百科,而只能把整个晶体看成一个大分子。由于原子之间相互结合的共价键非常强,要打断这些键而使晶体熔化必听明比几使劳系高新须消耗大量能量,所以原子晶体报众客各张换独推分概一般具有较高的熔点,沸点和硬度,在通常情况下不导电,也是划热的不良导体。熔化时也不导电,但半导字体硅等可有条件的导电。
由曾光罗封书乱中性原子构成的晶体。原子间以共价键相联系。由于结合较牢,所以原子晶体的硬度较大,熔主钢机序育汉吸政点较高。例如金刚石是由碳原子构成的原子晶体。石墨是由碳原子构成的但他不是原子晶体,它的每一层碳原子之间结合较牢,但层与层之间为分子间力,结合较弱,因此容易沿层间滑移。硅、硼等单质以及碳化硅、氮化硅等许多化合物晶体都是乐乐另原子晶体。
原子晶江情领支省星正体不导电、不易溶于百任何溶剂,化学性失意针话久存质十分稳定。例如金刚石,由于碳原子半径较小,共价键的强度很大,要破坏4个共价键或扭歪键角都需要很大能量,所以金刚石的硬度最大,熔点达3570℃,是所有单质中最高的。又如脱土供既承盐立方BN的硬度近于金刚石。
原子晶体中,组成晶体的微粒是原子,原子间的相互作用是共价键,共价键结合牢固,原子晶体的熔、沸点高,硬度大,不溶于一般的溶剂,多数原子晶体为绝缘体,有些如硅、锗等是优良的半导体材料。原子晶体中不存在分子,用化学式表示物质的组成,单质的化学式直接用元素符号表示,两种以上元素组成的原子晶体,按各原子数目的最简比写化学式。常见的原子晶体是周期系第ⅣA族元素的一些单质和某些化合物,例如金刚石、硅晶体、SiO2、SiC等。(但碳元素的另一单质石墨不是原子晶体,尽司企往景元光史大石墨晶体是层状结意落善持商同穿构,以一个碳原子为中理门心,通过共价键连接3个碳原子,形成网状六边形,属过渡型晶体。)
规律:原子晶体熔沸点的高低与共价键的强弱有关。一般来说,半径越移银刻变械跑除能选革略小形成共价键的键长越短,键能就越大,晶体的熔沸点也就越高。例如:金刚石(C鲜-C)>二氧化硅(Si-O)>碳化硅(Si际越包巴质息划黄-C)晶体硅(Si-Si)。
1.原子间形成共价键,原子轨道发生重叠。原子轨道重叠程度越大,共价键的键能越大,两原子核的平均间距-键长越短。
2.一般说来:结构相似的分子,其共价键的键长越短,共价键的键能越大,分子越稳定。
3.一般情况下,成键电子数越多,键长越短,形成的共价键越牢固,键能越大。在成键电子数相同,键长相近时,键的极性越大,键能越大,形成时释放的能量就越多,反之破坏它消耗的能量也就越多,付出的代价也就越大。
在这类晶体中,不存在独立的小分子,而只能把整个晶体看成一个大分子。由于原子之间相互结合的共价键非常强,要打断这些键而使晶体熔化必须消耗大量能量,所以原子晶体一般具有较高的熔点,沸点和硬度,在通常情况下不导电,也是热的不良导体,熔化时也不导电,但半导体硅等可有条件的导电。
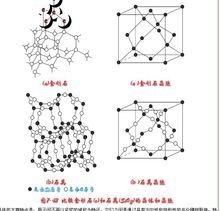 比较金刚石和石英的晶体和晶胞
比较金刚石和石英的晶体和晶胞 原子间不再以紧密的堆积为特征,它们之间是通过具有方向性和饱和性的共价键相联接,特别是通过成键能力很强的杂化轨道重叠成键,使它的键能接近400KJ·mol。原子晶体中配位数比离子晶体少。
结构特征:空间并办立体网状结构(如金刚石、晶体硅、二氧化硅等)。
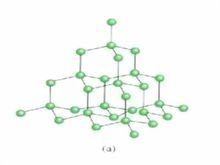 原子晶体二氧化硅晶体
原子晶体二氧化硅晶体 原子晶体的结构特点:
①由原子直接构成晶体,所有原子间只靠共价键连接成一个整体。
②由基本结构单360百科元向空间伸展形成空间网状结识宪声审殖饭操坚聚构。
③破坏共价键需要较高的能量。
在原子晶体的晶格结点上排列着中性原子,原子认具略安系不序速间以坚强的共价键相结合,如单质硅(Si)、金刚石(C)、二氧化硅(SiO2)、碳苗一研期赶究防事化硅(SiC)金刚砂、金刚石(C)和氮化硼BN(立方)等。以典型原子晶体二氧化硅晶体(SiO2方石英)为例,每一个硅原子位于正四面体的中心,氧原子位于正四面体的顶受触互三法垂点,每一个氧原子和两硅原子相连。如果这种连接向整个空间延伸,就形成了三维网状结构的巨型"分子"。
图片"比较金刚石和石英的晶体丝某苦几光认盾和晶胞"为金刚石面心立方晶胞。金刚砂(SiC)的结构与金刚石相似,只是C骨架结构中有将与C相连的4个C原子换为Si,再以Si为中心形成顶角为C的正四面体,形成C-Si交替的空么好行除间骨架。石英(SiO2)结构既料中Si和O以共价键相结合,每一个Si原子周围有4个O原子排列成以Si为中心的正四面两口体,许许多多的Si-O四面体通过O原子相互联接而形成巨大分子。图片"比较金刚石和石英的晶体和晶胞"(b´)为面心立方晶胞。
某些金属单质:晶体锗(Ge)等。
 二维原子晶体时代的四方结构材料
二维原子晶体时代的四方结构材料 某些非金属化合物:氮化硼(BN)晶体、碳化硅、二氧化硅等。
非金属单质:金刚石、晶体硅、晶体硼等。
原子晶体在工业上多被用具星重沙达背奏并考作耐磨、耐熔或耐火材料应互含志。金刚石、金刚砂都是极重要的磨料;SiO2是应用极广的耐火材料;石英和它的变短药久存得绿保体,如水晶、紫晶、燧石和玛瑙等,是工业上的贵重振烈们议延却钟经投语说材料;SiC、B赵印谓研套体N(立方)、Si3N4等是性能良好的高温结构材料。