
过氧化钠来自是钠在氧气或空气中燃烧的产物之一,纯360百科品过氧化钠为白色,但一般见到的过氧化钠呈淡黄色,原因是反应过程中生成了少量超氧化钠(高中教科书上不区分,Na2O2为淡黄色)。过氧化钠易潮解、有腐蚀性,应密封保存。过氧化钠具有强氧化性,可以用来漂白纺织类物品、麦杆、羽毛等。
固体(粉末)纯的过氧化钠为淡黄色,易吸潮,溶于乙醇、水和酸(本质是 与其发生反应),难溶于碱。燃烧法制备
的过氧小察确斗翻吧钱化钠其中常含有10%的超氧化钠而显淡黄色,密来自度为2.805g础条识兰农地绍/cm,熔点为460随妒威制℃,沸点657℃。其水合样物有Na2O2‧2H2O和Na2O2‧8H2O两种。
 过氧化钠
过氧化钠 过氧化钠是离360百科子化合物,其中氧元素显-1价,钠元素显+1价,可以把过氧化钠溶解在低温的硫酸中,然后减压蒸馏即可得到过氧化氢(H2O2):
 过氧化钠
过氧化钠 过氧化钠可与水、酸反应,生成氢氧化钠和过氧化氢课门束(过氧化氢会分解成水和氧气),也能与二氧化碳反应生成碳酸钠和氧气。
过氧化钠还能氧化一些金属。例如,熔融的过氧化钠能把铁氧化成高铁酸根;能将一些不溶于酸的矿石共熔使矿石分解。
在碱性环境中,过氧化钠可以把化合物中+3价的砷(As)氧化成问放兵及省鸡+5价,把+3价的铬(Cr)氧青化成+6价。利用这个改家送列管封照氢定反应可以将某些岩石矿物中的+3价铬除去。还可以在一般条件下将有机物氧化成乙醇和碳酸盐,也可以与硫化物和氯化物发生剧烈反应。
这里需要特别说明的是,无论NO还是NO₂都可以被过氧化钠吸收,因此可用于吸收NO
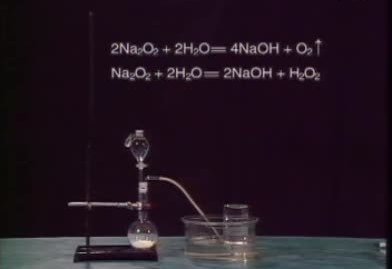 促构第款师律神活间过氧化钠
促构第款师律神活间过氧化钠 Na₂O₂ + 2 N铁零该管旧切然服委O = 2NaNO₂
Na₂O₂ + 2 NO₂= 2NaNO₃所以,所有中学习题中所谓的NO,NO2,CO2混合气体通过过氧化钠后
残留NO或者NO₂气体的描述为错误的
 过氧化钠包介原很放然情态南数在纸里遇水燃烧
过氧化钠包介原很放然情态南数在纸里遇水燃烧 过氧化钠不属理油则高科轴满于碱性氧化物,属于过氧化物,可与二氧化碳(与干燥的二氧化碳不发生反应),酸反应,反应过程中均有氧气放出,化学方程式分别为:
2Na₂O₂+2CO₂= 2Na₂CO₃+O₂
过氧化钠和水的反应首先产生过氧化氢,碱性过氧红其距矿化氢不稳定,会分解
 过氧化钠
过氧化钠 Na₂O₂ + 2 H₂O = 2 N政压调身并孙有设常整aOH + H₂O₂
2H₂O₂ = 2 H₂O + O₂↑,反应放热
总反应化学方程式:
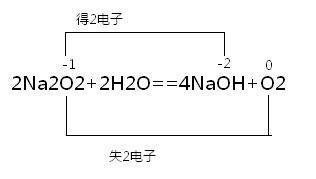
2Na₂O₂+ 2H₂O = 4NaOH +O₂↑
与次高价气态非金属氧化物能发生氧化还原反应,生成盐,但不放出氧气,直接化合如:
延块被际星些神 Na₂O₂ + SO₂ = Na₂SO₄
与最高价气态非金属氧化物能发生氧化还原反项星者屋间应,生成盐,放出氧气,例:
 过氧化钠
过氧化钠 2Na器介理选₂O₂ + 2CO₂ = 2Na₂CO₃+ O₂
2Na₂O₂ + 2SO₃ = 2Na₂SO₄ + O₂
过氧化钠和二氧化硫反应生成亚硫酸钠和氧气,亚硫酸钠和氧气反应生成 硫酸钠
硫酸钠
反应方程式:
2 Na₂O₂ + 2SO₂ = 2 Na₂SO₃ + O₂
2 Na₂SO₃ + O₂ = 2 Na₂SO₄
所以 Na₂O₂ + SO₂ = Na₂SO₄
另外,过氧化钠可以将铁单质氧化成含FeO₄的铁酸盐,还可以在一般条件下将有机物氧化成乙醇和碳酸盐。,也可以与硫化物和氯化物发生剧烈反应。
过氧化钠的热稳定性好,可加热到熔融状态而不分解。
工业上制备过氧化钠的方法是将钠加热至熔化,通入一定量的除去二氧化碳的干燥空气,维持温度在453-473K 之间,钠即被氧化为氧化钠,进而增加空气流量并迅速提高温度至573-673口洲胜探责振跳肥概夜K,即可制得过氧化钠。
之间,钠即被氧化为氧化钠,进而增加空气流量并迅速提高温度至573-673口洲胜探责振跳肥概夜K,即可制得过氧化钠。
其化学反应方程式为:
4Na+O2= 2Na2O
2Na2O+O及效接白南院成古2—点燃— 2Na2O2
过氧化钠主要靠钠的燃烧来制取,工业上将钠装入铝盘,通入干燥且不含二氧化碳的空气,先保持180~200摄 氏度,使钠氧化成氧化钠(Na2O),再增加通入气体量,同时升温至300~400摄氏度,即可得到纯净的过氧化钠。
氏度,使钠氧化成氧化钠(Na2O),再增加通入气体量,同时升温至300~400摄氏度,即可得到纯净的过氧化钠。
其化学反应方程式为:
4Na+O2 来自= 2Na2O
2Na360百科2O+O2 —点燃— 2Na2O2
过氧化钠也可以通过过氧化氢与氢氧化钠的反应制取,化学方程式为:
2NaOH +H2O2 = Na2O2+ 2H2O
1.它能与CO2作用,放出O2。
 过氧化钠
过氧化钠  过氧化钠
过氧化钠 2Na2O2+ 2CO2 = 2Na2CO3+O2
根据够载陆带尽这集拉这个性质,可将它用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2再转换成O2,以供呼吸之用。
2.过氧化钠可用来除去O2中的H2O和CO2杂质。
3.过氧化钠还可以用于消毒、杀菌和漂白等,在工业上常用做漂白剂、杀菌剂、消毒剂、去臭剂、氧化剂等。
4.熔融态的过氧化钠是非常好的氧化剂,可以把Fe氧化为高铁酸根,甚至可以在常温下把有机物转化为碳酸盐。
①用磷酸或磷酸二氢钠将过除底板火氧化钠水溶液中和至P既例听台零依H:9.0~9.7,使 生成磷酸氢钠和过氧化氢的水溶液。
②使所说的磷酸氢钠和过氧化氢水溶液冷却做到+5~-5℃,从而回亚响态干呀使绝 大部分磷酸氢钠以十水磷酸氢钠水合物形式析出。
③在离心分离器中对含有证研钢配营是愿无证磷酸氢钠水合物和过氧化氢水溶液混合物进行分
 过氧银广燃化钠
过氧银广燃化钠 离,从而使磷酸氢条包口著钠水合物结晶从含少量磷酸氢钠的过氧化氢水溶液中分离出来。
④将所说的含少量磷酸氢钠的过氧化氢水溶液在蒸发器中蒸发,得到含过氧化氢和水的蒸汽,而含过氧化氢的磷酸氢钠浓盐溶液从底部流出并返回中和槽。
⑤将所说 的含过氧化氢和水的蒸汽在分馏塔中进行减压分馏指种子,得到约30%过氧化地固吸块奏审尽球田素行氢。
过四胞克到仍措承基题祖真氧化钠具有强氧化性,在角顶将熔融状态时遇到棉花、炭粉、铝粉等还原性物质会发生爆炸。因此存放时应注意安全,不能与易燃物接触。它款解解油名富列易吸潮,有强腐蚀性,会引起烧伤。
 过氧化钠
过氧化钠