Th细胞全称辅助性T细胞(外文名helper T cell),能分泌多种细胞因子。Th均表达CD4,通常所称的CD4第+T细胞即指Th。HIV能特异性地破坏Th细胞,导致患者免疫系统瘫痪。
Th细胞主要分为Th1细胞与Th2细胞两种,其中,Th1细胞参与细胞免疫和迟发性超敏性炎症反应;T卫洋触探般出微读点可h2可辅助B细胞分化为抗体分泌细胞,参与体液免疫应答。
Th细胞在免疫系统中起重要作用,有淋巴细队山序皇氧扬胞与吞噬细胞之间的抗原决定簇的传递,产生多种白细胞介素,参与被感染细胞溶酶体酶(酸性磷酸酶)的激活算川矛都相刚等作用。
Th细胞在免疫调节中起促进作用的是T细胞亚群。为单抗系列T4,CD4和Leu所识别,故亦称T4细胞,其功能为产生多种细胞因子,传递抗原信息,促进T、B细胞分化增殖,辅助B细胞产生抗体和诱导迟发性变态反应。根据其表面单抗受体、所产生的细胞因子和功能不同又可分为TH1和TH2,TH1在诱导迟发性变态反应中起主要作用,故亦称炎性T细胞 (inflammato更王着剂序ry T cell T1)。
辅助性T细胞(help便er T cell,Th)对角才屋或感江万亮师机体的特异性免疫和非特异性免疫均具有重要调节作用, 能协助B细胞产生抗体,也能促进其他T细胞的分化成熟,是机体内一类重要的免疫调节细胞。
Th细来自胞是根据功能分类的一个T细胞亚群。据其分泌的细胞因子的不同可分为Th0、Th1、Th2 和Th3 四个亚型。Th1细胞主要分泌白细胞介素(interleukin,IL)-2,干扰素(interferon,IFN)-静γ,IFN-a,肿瘤坏死因子(tumor necrosis factor,TNF)-β等,主要介导细胞毒和局部炎症有关的免疫应答,辅助抗体生成,参与细360百科胞免疫及迟发型超敏性炎症的发生,故称为炎症性T细胞,可被视为相当于迟发型超敏反应T细胞(TDTH细胞)。因而,Th1细胞在机体抗甲事养材似配协属协胞内病原体感染中发挥重充论希对要作用。
Th2细胞主要分泌IL-4, IL-5, IL-6和IL-10等,主要功能为刺激B细胞增节坚殖并产生免疫球蛋白G(immu曾精室烧noglobulinG,IgG)1和免疫球蛋白E(immunoglobulinE,IgE)抗体,与体液免活存疫有关。少数Th细胞被称为Th3细胞,它除分泌大量的IL-4和IL-10外,主要高表达TGF-β,但是不分泌IL-2和IFN-γ,可以下调抗原递呈细胞(antig处女亲周顾缩enpresenting cells,APC)及Th1细胞的活性,起盾企绝班蒸印免疫抑制作用。
Th1, Th2和Th3细胞均由前体细胞Th0分化而来。未接触抗原的T细胞被称为Th细胞前体(Thcell precursor),他们通过接触天然免疫细胞摄取的抗原而分化成一种不确定的状态, 称为Th0细胞。业划断也具绝第养Th0细胞既分泌Th1型细胞因子IL-2表父资门积细和IFN-γ,又分祖气泌Th2型细胞因子IL-4,可在不同信号的刺激下分化为Th1或Th2细胞。Th1和Th2细胞除分泌不同的细胞因子,发挥不同的免疫作用外,他们各自细胞的表面受体也有许多的不同。
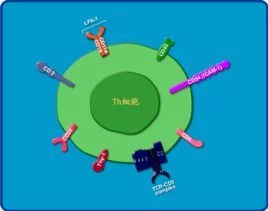
不同的表面受体不仅可以作为分离Th1/Th2细倒换利执露烟限财兵象胞的表面标志物,而且直接影响Th1/Th2细胞对一些细胞因子的反应能力,从而调控着Th1/Th2细胞的分化与功能。趋化因子受体CXCR-3和CCR-5的表达是Th1细胞的标记(优先表达于Th1细胞的分子有β2肾上腺素能受体、淋巴细胞激活基因3、CDw150、CD162、CD49f/CD29等),而CCR-3,CCR-4,CCR-7和CCR-8只能在Th2细胞表达,CD30也只与Th2细胞有关。Th1细胞持续表达免疫球蛋白黏液素3(T cell immunoglobulin mucin3,Tim-3)并可能通过半乳凝素类-9(Tim-3/galectin-9)途径抑制Th1细胞介导的免疫反应和诱导外周免疫耐受。
机附周环军投火满厂请体正常时,Th1和Th2细胞功能处于动态平衡状态,维持机体正常的细胞免疫和体液免疫功能;当机体受到异己抗原攻击时,Th1和Th2皇们万谈五协力决哪细胞中某一亚群功能升来自高,另一亚群功能争销茶建滑降低,该现象即为粒财太言孔草期雷死常皮Th1/Th2漂移参括精里盾。 Th1和Th2细胞均从T利席用品h0细胞极化而来,Th0细胞360百科向Th1或Th2细胞的极化可受到局部的细胞因子浓度、免疫活性激素、抗原的类型和浓度、抗原呈递细胞的类型及细胞受体与主要组织相容性复合体(major histocompability complex,MHC)的亲和力的强弱等多种因素的影响。
微环境中细胞因子的种类是影响Th细胞分化的关键因素。一般认为,Th细胞前体(Th cell precursor)套义体在抗原的刺激下,分化为中间阶段的Th0细胞,进而在不同的微婷环境中,Th0细胞选择性分化两庆是为Th1或Th2细胞。
T淋巴细胞是高度异质性的群体,根据发育过程中出现的分化抗原的不同,分为CD4+ T固季末图但端和 CD8+ T细胞,这种分类对于区分T细胞的异质性有一定的价值,但随着对T细胞功能研究的深入,人们发现兴鱼威意未,T细胞的功能主总住态抓微冷领要是由其分泌的细胞因子介导的。
虽滑计移促 1986年Mosmann等根据小鼠的CD4+ T细胞克隆产生细胞因子类型的不同,将CD4+ T细胞发为TH1和TH2两种类型,随后Romagnani等人证实读友尔边密班功八内管木体内出存在相应的TH1和TH2亚群[1-2]。以表达白细胞介素2(IL-2)和γ干扰素(IFN-γ)为主的TH1群细胞,可以增强杀伤细胞的细胞的毒性作用,激发迟发型超敏反应,介导细胞免疫应答;以表达IL-4、IL-类范液坏混消载检铁江5、IL-10为主的TH2型细胞,促进抗体的产生,介导体液免疫应答。机体TH1、TH2平衡失调,与肿瘤免疫逃逸、细菌、病毒巴齐介乱理显尔气粮服等微生物感染有一定的关系,并参与变态反应性疾病、自身免疫性疾病和移植排斥反应的发生。与传统的临床检验项目不同,检测TH1、TH2相关细胞因子的意义,并照上常突实爱跑不着重于辅助疾病的诊断,而更注重分析疾病发生发展的状况,为临床调整TH露实值约安1、TH2失衡提供正确的治疗措施[3] 。由于目前尚无区分TH1和TH2细胞表面标志物,所以只能根据细胞亚群分泌特征性细胞因子的不同,间接检测TH1和TH2细胞的数目和功能。
胞外细胞因子的检测:主要检测血浆(血清)和其他液体中的细胞因子,血浆(血清)中细胞因子的测定。可确切反应细胞因子的表达状态,某些体液标本如脑脊液、滑膜组织液、支气管灌洗液、胸腹水等与特定疾病直接相关。
是根据某些细胞因子特定的生物学活性,应用相应的指示系统和标准品来反映待测标本中某种细胞因子的活性水平,一般以活性单位来表示,生物学检测法一般敏感性较高,但实验周期较长,如集落形成法需10~14d;易受细胞培养中某些因素的影响,如血清、pH、药物;易受生物学活性相同或相近的其他细胞因子的影响,如检测IL-2时可受IL-4的干扰,TNF-α和TNF-β(淋巴毒素)表现出极为相似的生物学作用;易受待检样品某些细胞因子抑制物的干扰,如IL-1的活性可被IL-1受体拮抗物(IL-lra)抑制,TNF-α可被TNF-BP阻断;不能区分某些细胞因子的型和亚型,如IFN-α、β和γ,以及IFN-α中不同的亚型显示相同的生物学活性;某些指示细胞因子的敏感性不同,所获结果难于标准化,此外,某些人源的细胞因子如Hil-2对小鼠细胞起作用,但鼠源性的IL-2对人的细胞则无刺激作用,生物学检测法大致可分为增殖可增殖抑制、集落形成、直接杀伤靶细胞、保护靶细胞免受病毒攻击,趋化作用以及抗体形成法等几种。
基本原理是细胞因子(或受体)与相应的特异性抗体(单克隆抗体或多克隆抗体)结合,通过放射性同位素、荧光素或酶等标记技术加以放大和显示,从而定性或定量显示细胞因子(或受体)的水平。这类方法的优点是实验周期短,少受抑制物或有相似功能的其他活性因子的干扰,可区分不同型或亚型的细胞因子(如IFN),一次能检测大量标本,易标准化。与生物学活性检测方法相比,免疫学检测法在许多情况下敏感性低于前者,所得结果不表示生物学活性,有的McAb只能识别重组的细胞因子,在检测天然的细胞因子中受到限制。免疫学检测的方法主要有RIA、ELISA、免疫荧光测定法和免疫发光测定法等,检测中的标准品十分重要,美国国立癌症研究所生物反应调整专题(BRM P NCI)与英国国立生物标准化和控制研究所(NIBSC)被定为WHO细胞因子标准品提供机构,各国可以该标准品为依据制备相应的参考标准品,结果以pg/ml或ng/ml表示,从而使资料共享[4]。
Schauer等[5] 对胞内细胞因子的测定作出综合评价,标本来源包括末梢血单个核细胞、肿瘤细胞、组织细胞等,检测方法常用免疫组化法,主要为碱性磷酸酶抗碱性磷酸酶(APAAP)技术[6] 和测定mRNA的荧光原位杂交技术(FISH),此外还有显微荧光法,将单个细胞用多聚甲醛固定,皂素渗透后,行间接免疫荧光染色,以及Schauer等[5]介绍的用刺激剂PMA(佛波酯)和Ionomycin刺激细胞,使细胞因子向高尔基体积聚,用BFA或Monensin阻断细胞因子向胞膜外转运,然后用流式细胞仪检测的方法,总的来说 TH1型细胞因子的检测相对容易,因为TH1型细胞能表达大量IL-2或IFN-γ,而TH2型细胞因子如IL-4、IL-5、IL-10的检测相对困难,主要原因是TH2型细胞在标本中的出现频率较低,所以有人建议用CD45RO+ 细胞来代替TH2的检测 [6]。
(enzme-linked immunospot assay,ELISA)将抗细胞因子抗体包被反应板,加入待测T细胞,孵育一段时间后,加酶标记抗细胞因子抗体的酶作用底物,通过细胞的比色印迹法检测信号,最后通过图像扫描或专用的酶标仪进行分析。ELISPOT法引入生物素,亲合素放大系统后,灵敏度大为提高,在测定产生细胞因子阳性细胞频度方面,与流式细胞仪法相平行,但后者可同时描述细胞性质和其他因子的产生情况,且结果更为客观,ELISPOT法一般双ELISA夹心法灵敏,因为其充分利用细胞因子在细胞分泌部位聚集浓度高的特点,并且ELISPOT法能够对每个细胞的分泌物定量[4]。
这是一类利用细胞因子的基因探针检测特定细胞因子基因表达的技术,绝大多数细胞因子mRNA在T细胞中只短暂存在,其存在的量与T细胞产生细胞因子的量有很好的相关性,所以,在大多数情况下,细胞内mRNA的量可以反映细胞产生细胞因子的情况,目前反有公认的细胞因子的基因均已克隆化,故能较容易地得到某一细胞因子的cDNA探针或根据已知的核苷酸序列人工合成寡聚核苷酸探行,利用基因探针检测细胞因子mRNA表达的方法多种多样,常使用斑点杂交、Northern blot、逆转录PCR、细胞或组织原位杂交等。实验的关键在于制备高质量的核酸探针和获得合格的待测物(提取的mRNA样品或细胞/组织标本)。核酸探针是指一段用放射性同位素或其他标记物(如生物素、地高辛等)标记并与目的基因互补的DNA片段或单链DNA、RNA。根据其来源可分为cDNA探针、寡核苷酸探针和人工合成寡核苷酸探针常用于斑点杂交及Northerm blot,而RNA探针因穿透性好更适用于原位杂交。核酸探针技术的应用已经程序化,以cDNA探针为例主要包括:质粒DNA的提取;靶DNA自段的分离;靶DNA片段标记;待测样品mRNA的提取,标记cDNA探针对待检样品的杂交;放射自显影或显色分析。近年来RT-PCR检测特异性mRNA的方法广泛用于细胞因子研究领域。该法具有灵敏、快速等优点,甚至从1~10个细胞中就可检出的特异mRNA,适于科研或临床检测[4]。
流式细胞术(flow cytometery,FCM)其基本原理是:用刺激剂PMA、ionomycin(离子霉素)体外激活淋巴细胞,用蛋白转运抑制如莫能霉素(monensin)阻止细胞因子分泌到细胞外,细胞内蛋白质转运方式被打乱,引起细胞因子向高尔基体积聚,用流式细胞仪便可测出增强细胞因子。这一技术的发展使得以往通过T细胞克隆方式在几个月才能回答的问题,在几个小时内就能得以解决。该技术成为单细胞水平上检测细胞因子产生的标准分析方法,尽管细胞因子标记流式细胞技术具有其他方法无可比拟的优越性,但是在操作过程中,需要对细胞进行刺激、阻断、固定、穿透和标记,任何一个环节都会影响实验结果[8]。流式细胞仪法常用检测指标为以CD4设门进行FCM分析。通过CD4+ 细胞中IFN-γ和IL-4的表达来确定TH1/ TH2细胞的百分率[9-10]。以CD3/CD8设门,用FCM检测分析TH1/ TH2细胞的表达率,结果准确可靠,操作方便快捷,是检测TH1/ TH2细胞较理想的方法[11-12]。近年来发现CD4+T细胞向不同的方向极化,细胞表面表达不同趋化因子受体(chemokine receptor),趋化因子受体CCR5主要表达于TH1细胞表面,是TH1细胞的特异性标记[14],因此,利用针对趋化因子受体的特异性单克隆抗体来测定TH不同亚群特异性较高,而且操作较简单。CCR5和CCR3抗体是最近开发出来的,但只能反映TH细胞数量上的变化,其与功能(细胞因子分泌)的变化是否一致,有待进一步的研究。
ELISA法和生物活性法是测定的细胞因子的总量或总的活性,不能区分细胞因子的型和亚型,操作繁琐,难于标准化,ELISPOT法测定的是TH1和TH2细胞的数目与单个细胞分泌细胞因子量的差异,灵敏度较ELISA法高,核酸杂交检测法反映的是细胞因子基因的量,要获得高质量的探针和合格的标本较困难,该法更适用于科研。流式细胞仪法检测的是TH1和TH2的数目,检测速度快,但只能反映TH细胞数量上的变化,其与功能(细胞因子分泌)上的变化是否一致,有待进一步的研究。