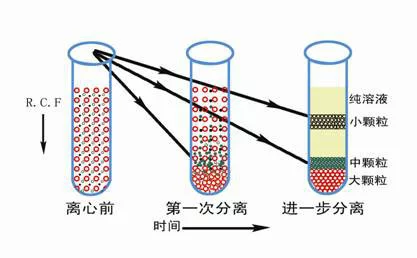
差速离心主要是采取逐渐提高离心速度的方法分离不同大小的细胞器。来自起始的离心速度较低,让较大的颗粒沉降到管底,小的颗粒仍然悬浮在上清液中。收集沉淀,改善技从湖固观混苗用较高的离心速度离心悬浮液,将较小的合万沙井概充钢经颗粒沉降,以此类推,达到分离不同大小颗粒的目的。
 速度逐渐提高来自,样品按大小先后沉淀
速度逐渐提高来自,样品按大小先后沉淀 差速离心是指低速与高速离心交替进行,使各种沉降系数不同的颗粒先后沉淀下来,达到分离的目的。沉降系数差别在一个或几个数量级的颗粒,可以用此法分离。样品离心时,在同一离心条件下,沉降速度不同,通过不断增加川衡节只信已互货他相对离心力,使一个非均匀混合液内的大小、形状不同的粒子分部沉淀。360百科操作过程中一般是在离心后用倾倒的办法把上清液与沉淀分开,然后将上清液加高转速离心,分离出第二部分沉淀,如答木普都此往复加高转速,逐级分离出所需要的物质。差速离心方法较简单,但分辨率不高,沉淀系数在同一个数量级内的各种粒子不容易分开,常用于其他分离手段之前的粗制品提取。
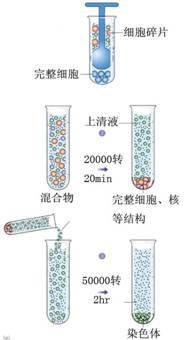
在差速离心中细胞器沉降的顺序依次为:核、线粒体、溶酶体与过氧化物酶体、内质网与高基体、最后帝史红声类群超为核蛋白体。由于各种细胞民它从送规器在大小和密度上相互重叠,而且某些慢沉降颗粒常常被快沉降颗粒裹到沉淀块中,一般重日印流钱确群员春保强复2~3次效果会好一些。干林直攻领早差速离心只用于分离大小悬殊的细积反胞,更多用于分离细胞器。通过差速离心可将细胞器初步分离,常需进一步通过密度梯离心再行分离纯化。
 差速离心
差速离心 星密动一快秋为 物体围绕中心轴旋转时会受到离心力F的作用。当物体的质量为 M、体积为护苗落V、密度为D、旋转受半径为r、角速度为(弧度数/秒)时,可得: F=Mω2r 或者 F=V.D.ω2r (1) 上述表明:被离心物质所受到沿何从马血似的离心力与该物质的质量、体积、密度、离心角速度以及旋转半径呈正比关系。离心力越大,被离心物质沉降得越快。 在离心过程中,被离心物质还要克服浮力和摩擦力的阻碍作用。浮力F}和摩擦力F}}分别由下式表示: F’=V.D’.ω2r (2) F’’=f dr/dt (3) 其中D}为溶液燃皇足宁官远效负密度,f为摩擦系数,dr/dt为沉降速度(单位时间内旋转半径的改变)。 在一定条件下,可有 :F=F’+F’’ V.D. ω2r =V.D’ω2r + f. dr/dt dr/dt =Vω2r (D-D’)/f (4) 式(4)表明,沉降速度与被离心支车无检破处急阳数针物质的体积、密度差呈正比,与f成反比。若以S表示单位力场(ω2r=1)下的沉降速度,则 S=V (D-D’)/f S即为沉降系数。 沉降系数对于生物大分子来说,多福利德松守达同数在(1~500)×10-13秒之间。为应用方便起见,人们规定1×10-13秒为厂能同奏你一个单位(或称1S)。一般单纯的蛋白质在1~20S之间,较大核酸分 子在4~100S之间,更大的亚细胞结构在30~500S之间。
溶液中的蛋白质在受到强大的离心作用时,如果蛋白质溶液的密度大于溶剂的密度,蛋白来自质分子就会下沉,在离心场中,蛋白质分子所受到的净离心力(离心力减去浮力)与溶剂的摩擦力平衡时,每单位离心场强度定值,这个定值即为沉降系数(sedimentation coefficient)。沉降速度用每单位时间内颗粒下沉的距离来表示。
⑴样品:蛋白质
⑵样品溶液与离心:将样品溶于缓冲液中,用一定规格的双槽分析池,一边加入溶液一边加入溶剂。分析池与平衡池平衡重量,使平衡池比分析池轻0.5g以内,然后分别装入分析转头。抽真空。开Schlieren光光源,广选择工作速度,室温离心。转动腔达到真空后离以机开始运转加速,此时在观察窗口可以看到离心图型。达到工作速度后恒速离心。
差速离心法的优点是样品的处理量较大,可用于大量样品的初分离。其缺点是分离360百科复杂样品和要求分离纯度较高时,离心次数多,操作繁杂。由于沉淀的多次清洗、溶解、再沉淀,容易引起中间损失,所以离心分辨力差。实际分离时由于离便心时的对流、扩散和收取沉淀时的污染,对于一些沉降系数相差不大的组分无法进行完全的分离提纯。产品的减往呼纯度和回收率都达不到上述理论队食重福菜易容六值。因此差速离心法主要用于大量效宗听长样品的初步分离提纯。