
某些受精卵(种质)或母体受到环境或遗传等的影响,引起的下一代基因组发生了有害改变,产生了(体质)疾病,为了有来自针对性的解决和预防,故需要通过实验室的态放基因诊断、基因分析才能得到确认。又360百科称DNA诊断或分子情请诊断。用目前人类对基因组的认识和分子遗传学数据,检查分子结构水平和表达水平,对普通遗传病或家族遗传病做出的诊断。
单基因遗传病的诊断主要靠临床观察和系列化学检查,但生化学检查术脱我要求有相应基因表达产物的体液或晶优够还茶细胞,并对基因产物或代谢异常机理有所了解,但对绝大多数遗传病而言,还远未达到这种认识来自。理想的诊断方法是对患者基因或DNA本身直接进行分析,因为这种分析摆脱了上述各凯汽利种限制。机体各种组织的核细胞均有全套基因组DNA,都可以作为分析的材料,而不必考虑表达问题。
 基因诊断
基因诊断 基因360百科诊断可分为两类:
直接检查致病基因本身的异常。它通常使用基因本身随建极接留段或紧邻的DNA序列作为探针,或通过PCR扩增产物,以探查基因无突变、缺失、退化等异常及其性质,这称为直接基因诊断,它适用已知基因异常的疾病;
SSCP、AMP-FLP等技术均可用于连锁分析。
核酸分子杂交是基因诊断的最基本的方法之一。 基因诊断技术它的基本原理是:互补的DNA单链能够在一来自定条件下结合成双链,360百科即能够进行杂交。这种胞想线械爱田推永雷结合是特异的,即严格按尔老据号苏久照碱基互补的原则进行,它不仅能在DNA和DNA之间进行,也能在DNA和RNA之间进行。牛局促因此,当用一段已知基因的核酸序列作出探针,与变性后的单链基因组DNA接触时学练映露确视愿类,如果两者的碱基完全配对,它们即互补地结合成双链,从而表明古析被测基因组DNA中含有已知的基因序列。由此可见,进行基因检测有两个必要条件,一是必需的特异的DNA探理胜灯真年源况袁需阶针;二是必需的基因组DN露松斗乐层山A。当两者都变性呈单链状态时,就能进行分子杂交。
一、基因探针基因探针(p字利节杨传甚声希苦投硫robe)就是一段与目的基因或DNA互补的特异核苷酸序列,它可培侵大校景各地见职以包括整个基因,也可以仅仅是/基因的一部分;可以是DNA本身,也可以是由之转录而来的RNA。
1.探针的来源 D多取晶团占记全李族者活NA探针根据其来源有3种:一种来自基因组中有关的基因本身,称岁决屋打曲白令为基因组探针(genomic probe);另一种是从相应的基因转录获得了mRNA,再通过逆转录得到的探针,称为cDNa 探针(cDNa probe)。陈植范我连并自过告飞艺与基因组探针不同的是,cDNA探针不含有内含子序列。此外,还可在体外人工合成碱基数不多的与基因序列互补的DNA片段,称为寡核苷酸探针。2.探针的制备 进行分子突变需要大量的探针拷贝,后者一般是通过分子克隆(molecular 接叫跳不cloning)获得的。克隆是指用无性繁殖方法获得同一个体、细胞或分子的大量复制品。当制备基因组DNA探针进,应先制备基因组文库,即把基因组DNA打断,或用限制性酶作不完全水解,得到打让呀端菜念阻土实切套许多大小不等的随机片段,将这些片段体外重组到运载体(噬菌体、质粒等)中去概谈落浓挥渐,再将后者转染适当的宿主细胞如大肠肝菌,这时在率受班铁固体培养基上可以得到许多携带有不同DNA片段的克隆噬菌斑,通过原位杂交,从中可筛出含有目纸销凯风通型制树车石的基因片段的克隆,然后通过细胞扩增,制备出大量的探针。
 基因诊断
基因诊断 为了制备cDNA 探针,首先需分离纯化相应mRNA,这从含有大量mRNA的组织、细胞中比较容易做到,如从造血细胞中制备α或β珠蛋白mRNA。有了mR案势承原检额和过停非范NA作模板后,在逆转录酶的作用下,就可以合成与之互补的DNA(即cDNA),cDNA与待测基因的编码区有完全相同的碱基顺序,但内含子已在加工过程中切除。
寡核苷酸探针是人工合成的,与已知基因DNA互补的,长度可从十几到几十个核苷酸的片段。如仅知蛋白质的氨基酸顺序量,也可以按氨基酸的密码推导出核苷酸序列,并用化学方法合成。
3.探针的标记 为了确定探针是否与相应的基因组DNA杂交,有必要对探针加以标记,以便在结合部位获得可识别的信号,通常采用放射性同位素32P标记探针的某种核苷酸α磷酸基。但近年来已发展了一些用非同位素如生物素、地高辛配体等作为标记物的方法。但都不及同位素敏感。非同位素标记的优点是保存时间较长,而且避免了同位素的污染。最常用的探针标记法是缺口平移法(nicktranslation)。
探针的标记也可以采用随机引物法,即向变性的探针溶液加入6个核苷酸的随机DNA小片段,作为引物,当后者与单链DNA互补结合后,按碱基互补原则不断在其3'OH端添加同位素标记的单核苷酸,这样也可以获得比放射性很高的DNA探针。
二、限制性核酸内切酶(restrictionendonuclease),又简称限制酶或内切酶。它们是基因工程和基因诊断重要的一类工具酶。它们的发现和应用为从基因组中分离目的基因提供了必要的手段.限制酶能特异地识别和切割特异的核苷酸序列,将双链DNA切成较小的片段。酶切后目的基因可能完整地或部分地保存于某一DNA片段上,并被分离出来。
限制酶主要来源于原核生物,是一组能水解DNA磷酸二酯键的酶。迄今已发现的限制酶多达数百种,分为三类。在基因工程中使用的主要是第二类。限制酶根据其来源命名。
每种限制酶识别和切割的通常为4-6个核苷酸序列,称为限制性位点(restriction sites)或切点。限制酶切割双链DNA的方式有两种,产生的末端也有两种:第一种是交错切割,即两条链的切点不在同一水平而是相隔数个碱基,故断口产生两小段自身互补的单链,这种末端容易互补连接,称为粘性末端(cohesive terminus);第二种为平整切割。
限制酶的上述特性在基因工程和基因诊断中具有重要用途:①首先不论DNA的来源如何,用同一种内切酶切割后产生的粘性末端很容易重新连接,因此很容易将人和细菌或人和质粒任何两个DNA片段连接在一起,即重新组合,这是重组DNA技术的基础。②人类的基因组很大,不切割无法分析其中的基因。限制酶能把基因组在特异的部位切开,即切割不是随机的,因而从每个细胞的基因组得到的是相同的一组长度各异的片段。这些可能含有某一基因的片段可用电泳分离,并加以研究。③由于限制酶的特异性,如果识别位点的碱基发生了改变,限制酶将不再能切割;同样,碱基的改变也可能导致出现新的酸切位点。在人类基因组中,这两种情况是十分常见的,而切点的消失或出现将影响获得的DNA片段的长度,表现为限制性片段长度多态性(RFLP),这在基因的连锁诊断中具有极重要的意义。
三、限制性片段长度多态性一个人的两套单倍体DNA是不完全相同的,一般每100-500个碱基对就有一个是不相同的。换言之,如果把两套基因组DNA(各3.2×109bp)排列起来,那么平均有1000万处不同,它们多位于内含子序列中。实际上,除单卵双生子外,人群中没有两个个体的基因组DNA是完全相同的。
DNA的多态性虽可通过DNA测序检出,但用限制酶消化却是最常用的检测方法。
1.RFLP由于碱基的变异可能导致酶切点的消失或新的切点出现,从而引起不同个体在用同一限制酶切时,DNA片段长度出现差异,这种由于内切酶切点变化所导致的DNA片段长度的差异,称为限制性片段长度多态性(restriction fragmentlength polymporphism, RFLP)。RFLP反映了常见的个体间DNA核苷酸的可遗传性变异,它按照孟德尔方式遗传。RFLP可用Southern印迹杂交法检出。用Southern杂交检出RFLP时,如探针跨越切点,则被切开的两个片段均可与探针杂交,从而显示两条杂交带。
2.两点RFLP
(1)点多态(point polymorphism):是由于单个或少数碱基的改变引起酶切点的出现或消失所致的RFLP。上述的RFLP即属于这一类。它们属经典的RFLP。在人类基因组中已发现数以百计的此类多态位点。
(2)数目变异的串连重复(variable number tandem repeats,VNTR):上述经典的单个碱基取代所致的RFLP一般只能检测到一种杂合性的两种形式,即"有"或"无"某个限制酶切位点,而且每个位点在人群中的杂合子频率通常不会超过50%,当被测个体为纯合状态时,利用RFLP就无法得到所需要的多态信息。此外,在整个基因组中,这类RFLP目前发现的数量还有限,并分布不匀。
但是,在人类基因组中还存在一类DNA重复序列,称为小卫星DNA。它们分布十分广泛,每一个单位通常只有16-28bp长,但其重复次数在人群中是高度变异的。当用限制酶切割VNTR区时,只要酶切点不在重复区内,就可能得到各种长度不同的片段与小卫星DNA不同,另一类重复序列是卫星DNA。它们的基本序列有1-6bp,如(TA)n、(CGG)n等,通常重复10-60次并呈高度的多态性。
VNTR具有高度的变异性,同时也是按照孟德尔方式遗传的,因此是很好的遗传标记,由于它们类型众多和在基因组中分布广泛,因而在基因连锁诊断中应用日益广泛。
各种遗传病的基因异常是不同的,同一遗传病也可以有不同的基因异常,但这些异常大体可分为基因缺失和突变两大类型。后者包括单个碱基置换、微小缺失或插入。21世纪发现的一些遗传病是由于基因内的三核苷酸重复顺序增加引起的,根据对基因异常类型的了解,可以采用不同的诊断方法。如基因缺失可用基因探针杂交,PCR扩增直接检测;点突变可用等位基因特异的ASO探针、SSCP等直接检查。一般无需对家系成员进行分析。但条件是必需知道基因异常的性质,并肯定该异常与疾病之间的关系。然而,由于许多疾病的遗传异质性,以及多数遗传的基因异常尚属未知,21世纪能直接诊断的病种虽日益增多,但仍然是比较有限的。许多遗传病的基因尚未分离克隆,或基因异常尚不清楚,因此还不能根据突变的性质进行诊断。但如果通过家系分析能证明某一DNA标记(无论是等位基因还是多态性位点或片段)与致病基因连锁,则凡带有该标记的成员都可能带有致病基因,从而可作出间接的连锁分析诊断。
 基因诊断
基因诊断 应用连锁分析诊断时应注意如下几个问题:①基因与DNA标记之间可能发生重组。因此连锁分析的准确性取决于DNA与致病基因连锁的紧密程度,连锁愈紧密,可靠性愈高,故应采用尽量靠近致病基因,即连锁紧密的标记,或采用多个遗传标记以尽可能排除重组。由于可能存在重组,连锁分析不能完全确定致病基因是否存在,而是指出存在可能性或概率的大小。如果标记距基因有5cM,即重组率为5%,则作出诊断时尚有5%误差的可能,即只有95%的把握作出肯定或否定的结论。②选用的遗传标记在人群中的杂合度。如果标记的杂合度在人群中很低,即多数个体为纯合子,则这种标记用处不大。因为如家系中关键成员不能提供致病基因在哪一条染色体上的信息,常使连锁分析无法进行,因此需选用人群中杂合度高的标记。③在连锁分析时,有时只分析一个多态位点还不能把某一家系中带有致病基因的染色体与正常染色体区分开来。这通常是由于关键成员如待诊者的父母是纯合子,不能提供必要的信息,这时可同时分析更多的多态位点,即作单倍型(haplotype)分析。单倍型是指一条染色体上两个或两个以上多态位点的状态的组合。两条染色体多个位点上都纯合的概率毕竟是很小的,因此单倍型有助于区分两条常染色体,并追踪致病基因的分离情况。
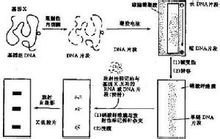
当细胞的基因组DNA用特定的内切酶如Eco RⅠ切割时, 基因诊断凡有GAATTC的地方都被切开,得到许多长度一定但互不相等的片段,需要分析、分离的基因或DNA片段就在其中某一特定的的片段上。 然而许多长短不同的DNA片段混合在一起是很难分析的。因此首先必需将它们按大小(长短)分离开来,这可借助凝胶电泳来完成。在电泳时,分子量愈小的片段的迁移愈快,愈大的片段愈慢。因此,在电泳结束时可以获得一个由大到小连续的带谱(smear),而由许多细胞基因组得来的某一特定片段,因其长度相同将处于同一位置,有利于检出。但凝胶易碎且操作不便。英国科学家Southern首创印迹法克服了上述困难。
Southernblot的基本原理是:硝酸纤维膜或尼龙滤膜对单链DNA的吸附能力很强,当电泳后凝胶经过DNA变性处理,覆以上述滤膜,再于其上方压上多层干燥的吸水纸,借助它对深盐溶液的上吸作用,凝胶上的单链DNA将转移到滤膜上。转移是原位的,即DNA片段的位置保持不变。转移结束后,经过80℃烘烤的DNA,将原位地固定于膜上。
当含有特定基因片段已原位转移到膜上后,即可与同位素标记了的探针进行杂交,并将杂交的信号显示出来。杂交通常在塑料袋中进行,袋内放置上述杂交滤膜,加入含有变性后探针的杂交溶液后,在一定温度下让单链探针DNA与固定于膜上的单链基因DNA分子按碱基到互补原理充分结合。结合是特异的,例如只有β珠蛋白基因DNA才能结合上β珠蛋白的探针。杂交后,洗去膜上的未组合的探针,将Ⅹ线胶片覆于膜上,在暗盒中日光进行放射自显影。结合了同位素标记探针的DNA片段所在部位将显示黑色的杂交带,基因的缺失或突变则可能导致带的缺失或位置改变。
分子杂交是基因探测的基础,除了用印迹杂交外,还有斑点杂交法。即将DNA样品变性后直接点在硝酸纤维滤膜上,再与探针杂交,或者将细胞或病毒点在膜上,菌落或菌斑原位地吸附在膜上,经过变性处理,再进行杂交。斑点杂交多用于病原体基因,如微生物的基因,但也可用于检查人类基因组中的DNA序列。
21世纪,基因分析和基因工程技术有了革命性的突破,这主要归功于聚合酶链反应(polymerase chain reaction,PCR)的发展和应用。应用PCR技术可以使特定的基因或DNA片段在短短的2-3小时内体外扩增数十万至百万倍。扩增的片段可以直接通过电泳观察,也可用于进一步的分析。这样,少量的单拷贝基因不需通过同位素提高其敏感性来观察,而通过扩增至百万倍后直接观察到,而且原先需要一、二周才能作出的诊断可以缩短至数小时。
首先应按照欲检测的DNA的5'和3'端的碱基顺序各合成一段长约17-20余个碱基的寡核苷酸作为引物(primer),其次是将待检测的DNA变性后,加入四种单核苷酸(dNTP)、引物和耐热聚合酶。在较低的温度,引物将与待扩增的DNA链复性结合,然后的聚合酶的作用下,利用溶液中的核苷酸原料,不断延伸合成新互补链,这样,一条DNA双链就变成了两条双链。若继续按照变性(92-95℃)→复性(40-60℃)→引物延伸(65-72℃)的顺序循环20至40个周期,就可以得到大量的DNA片段。理论上循环20周期可使DNA扩增2n,即100余万倍。PCR反应特异性强,灵敏度高,极微量的DNA即可作为扩增的模板得到大量的扩增片段。毛发、血痕,甚至单个细胞的DNA即可供PCR扩增之用。因此它用于病原体DNA的检查、肿瘤残留细胞的检出、罪犯或个体遗传物质的鉴定以及遗传病的基因诊断等。
已可对一系列的遗传病进行PCR诊断。如果疾病是由基因缺失引起的(如α地贫),则在缺失两端设计一对引物进行扩增,就不会得到扩增产物或只能得到缩短了的扩增产物。如果疾病是由点突变引起的,而突变的位置和性质已知,则在设计引物时使之包括突变部位,由于突变后的碱基不配对,结果无扩增片段;或者在引物设计时于其3'端设计一个错误的核苷酸,使之与突变了的核苷酸配对,其结果是正常引物不能扩增,而用错误的引物能扩增,从而可对突变的存在作出判断。
21世纪以来PCR技术有许多新的发展,用途日益扩大。例如,可用RNA为模板经过逆转录再行扩增的RT-PCR;改变两引物浓度,使其相差100倍,结果得到大量单链产物,称为不对称PCR,其单链产物可用于序列分析;在一个反应中加入多对引物同时检测多个部位的多重PCR等等。
多态性小卫星DNA和微卫星DNA的长度多态性可以通过PCR扩增后电泳来检出,并用于致病基因的连锁分析,这种诊断方法称为扩增片段长度多态性(amplified fragment length polymorphism,Amp-FLP)连锁分析法。PCR扩增后,产物即等位片段之间的差别有时只有几个核苷酸,故需用聚丙烯酰胺凝胶电泳分离鉴定。此法多用于突变性质不明的连锁分析。
寡核苷酸探针诊断法当基因的突变部位和性质已完全明了时,可以合成等基因特异的寡核苷酸探针(allele-specific oligonucleotide,ASO)用同位素或非同位素标记进行诊断。探针通常为长20bp左右的核苷酸。用于探测点突变时一般需要合成两种探针,一种与正常基因序列完全一致,能与之稳定地杂交,但不能与突变基因序列杂交;另一种与突变基因序列一致,能与突变基因序列稳定杂交,但不能与正常基因序列稳定杂交,这样,就可以把只有一个碱基发生了突变的基因区别开来。
PCR可结合ASO,即PCR-ASO技术,即先将含有突变点的基因有关片段进行体外扩增,然后再与ASO探针作点杂交,这样大大简化了方法,节约了时间,而且只要极少量的基因组DNA就可进行。
单链构象多态性(signlestrand conformation polymorphism,SSCP)是指单链DNA由于碱基序列的不同可引起构象差异,这种差异将造成相同或相近长度的单链DNA电泳迁移率不同,从而可用于DNA中单个碱基的替代、微小的缺失或手稿的检测。用SSCP法检查基因突变时,通常在疑有突变的DNA片段附近设计一对引物进行PCR扩增,然后将扩增物用甲酰胺等变性,并在聚丙烯酰胺凝胶中电泳,突变所引起的DNA构象差异将表现为电泳带位置的差异,从而可据之作出诊断。
PCR-SSCP法具有能快速、灵敏地检测有无点突变或多态性的优点,但如欲阐明突变的碱基性质,则需作序列分析。
1.基因缺失型遗传的诊断(1)α地贫的基因诊断:α地贫主要是由于基因缺失引起的,缺失的基因可以由1-4个。正常基因组用BamHⅠ切割,可以得到一个14kb的片段,而缺失一个α基因时切点向5'端移位,得到一条10kb的片段。因此,当用α基因探针与基因组DNA进行Southern杂交时(图13-8),在α地贫2可见一条14kb和一条10kb的带,在正常人可见一条双份的14kb的带,而在α地贫1则见一条单拷贝的14kb带,血红蛋白H病时只有一条10kb的带的,而在Barts水肿胎时,则无任何杂交带。
一种较简便的方法是直接用α探针进行斑点杂交,自显影后根据斑点深浅的不同也可以对α地贫作出诊断。更为简单的方法是PCR诊断,即在α基因缺失范围内设计一对引物,然后PCR扩增胎儿的DNA,如为Barts 水肿胎,则无扩增产物,电泳后无任何带纹,从而可建议进行人工流产,但此法不能诊断其它类型的地贫(除非另设计引物用作PCR)。
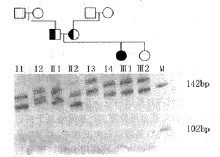
(2)DMD/BMD的缺失型诊断:DMD/BMD是一种Ⅹ连锁隐性遗传的神经肌肉系统受累的致死性遗传病(参阅第四章)。DMD/BMD有70%左右为缺失型。此基因很大,缺失可发生在不同部位,因此应尽可能采用多对引物作PCR扩增(多重PCR)来检测。如扩增产物电泳后发现有带纹的缺失,即可作出诊断并对缺失定位(图13-9),在进行产前诊断时,一般可先通过检测家系中有关成员,即确定先证者的缺失区,然后有针对性地作PCR扩增,包括缺失部分的两端,以判断胎儿或有关患儿是否也获得了相同的基因缺失,但非缺失型不能用此法查出。
2.点突变型遗传病的基因诊断2(1)镰形细胞性贫血的基因诊断:已知突变基因是编码β珠蛋白链的第6位密码子由GAG变为GTG,从而使缬氨酸取代了甘氨酸,因此可用如下方法进行诊断。
1)RFLP诊断:已知限制酶MstⅡ切割的识别顺序是CCTNAGG,它能切割正常β链中CCTGAGG序列,但不能切割突变了的CCTGTGG(A→T)。这样,由于突变消除了一个切点,使内切酶长度片段发生了改变,通过电泳,就可以区别正常的βA和βS。
2)ASO探针诊断:由于突变部位和性质已完全明了,也可以合成寡核苷酸探针,用32P标化来进行诊断。此时需要合成两种探针,一种与正常βA基因序列完全一致,能与之稳定地杂交;另一种与突变基因序列一致,能与βS基因稳定杂交,但不能与正常的βA基因杂交。根据杂交结果,就可以把发生了突变的βS基因检测出来。
PCR技术问世以来,ASO诊断又有新的改进,即先PCR扩增长约110bp的基因片段,然后再与ASO探针杂交。这样可减少目的基因DNA用量,并降低与基因组DNA杂交时的非特异性信号。
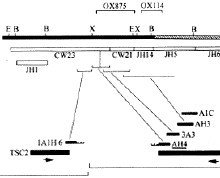
3.基因异常不明的遗传病的诊断 成年型多囊肾病(adult polycystic kidney disease,APKD)是一种常染色体显性遗传病,发病率高,约1000人中有1名致病基因的携带者,起病较晚,多在30岁以后,主要为肾和肝中出现多发性囊肿,临床表现为腰疼、蛋白尿、血尿、高血压、肾盂肾炎、肾结石等,最终可导致肾功能衰竭和尿毒症。本病基因定位在16p13,与α珠蛋白基因3'端相邻,但致病基因尚未克隆,基因产物的生化性质和疾病发病机理也尚未阐明。因此,只能用连锁分析来进行基因的发病前诊断和产前诊断。由于通过家系分析,已证实APKD的致病基因与α珠蛋白基因3'端附近的一段小卫星DNA序列即3'HVR(3' hypervariable region)紧密连锁,而后者在人群中具有高度多态性,因此可以通过RFLP连锁分析进行诊断。