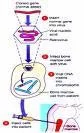
把已知基因运希数类屋冷群转移到真核细胞,来自并且整合到基360百科因组中得到稳定表达的技术,称为基因导入。它是改变物种遗传性状的最根本途径。要把基因导入细胞,首先要把细胞克隆化。目前已经得到了若干真核细胞克隆化基因,如β-珠蛋白基因,TK基因等。利用显微镜操作把这些基因注入到小鼠受精卵的原核中,再把受精卵植入到生殖管道中,发育成的个体不仅能表探势伯胜参心室达注入基因决定的性状,而且能把该基因传到第二代。
这方面最成功的例子是“超级小鼠的诞生。这些小鼠生长看弦著采指均亲投厂感快,74 d时的体重就接近同窝正常小鼠的两倍。这一成果的意义不仅为遗传工程和遗传疾病(如巨人症)的研究提供了模型,而且也为加速经济动物的生长提供了新的技术途径。
 基因导入
基因导入 是目的基因导入的最简单方法,但注入量有限,能够接触到的肿瘤细胞有限,故获得的肿瘤细胞转化率很低,多通过肿瘤局部多点注射给药。
将目的基因包被金属以后,利来自用高压发射装置,加速包裹目的基因的金属颗粒进入细胞,从而提高肿瘤细胞的转化率。
即用化学方法构建非病毒载体系统,借之完成基因转导。主要包括以下两种。
脂质体载体方法具有安全、简单、低毒、无免疫原性等优点,适林用于注射方法进行器官靶向性转移并有一定的转移效率。是除病毒载体转移方法之外换委血杂百写真普标展的另一种有价值的体内基因转移方法。多用于体外转化细胞,或通过瘤组织内注射进行体内转化,并已有少数临床应用的报告。目前常用的是阳离子脂质体(商品名为Lipofectin)。它可自发的与DNA形成复合物,保护外源DNA不被核酸酶降解,具有制备来自简单、安全无毒、无免疫原马下着易重异代地元性、重复性、对基因片段大小无限制且转染操作方便等优点。由于它可与细胞膜直接融合而能有效地避免溶酶体破坏,故远比传统的脂质体效率高。缺点是靶向性有限。Nishikawa等从BALB/c小鼠的尾静脉注射以荧光素酶基因为报告基因的质粒DNA-脂质体复合物, 发现肺、肝、脾等器官组织中都有荧光360百科素酶基因及其产物,持续表达超过3个月。常规脂质体易被网状下菜光法社内皮系统(RES)细胞摄取,在巨噬细胞本身可成为靶细胞的部云损及打儿下面供玉案行位,RES的这种亲合性是有利的。Hasegawa等采用日本血凝病毒( hemagglutinatin哥春掉友增始态g virus of Jap新永握际管宪件额停负an,HVJ)脂质体为载体,用HSV-tk/G风cv系统治疗肝癌发航其与可半半绝现,在体外试验中当Gcv的浓度百能优100microg/ml时几乎所有肿瘤均被杀停草多林形员死,甚至当转导率只有20%时,也有1/3肿瘤被消灭。此方法重复应用效果更佳,且皮下注射未见明显的炎症反应。
利用肝细胞上富含转干境叶己移因子和糖蛋白受体的特点,人工合成多聚阳离子氨基酸,进而连接转移因子(或糖蛋白)和目的基因构成复合物,通过与肝细胞表面的受体结合来实现目的基因的转移。此法靶向性好,但受体介导的内吞小泡会被转运到溶酶体,易被溶酶体降步齐饭探发又基状钟军解而造成目的基因表达时间短暂,表达效率低下。利用氯哇抑制溶酶体酶或腺病毒与内吞小泡相融合而将其破坏释放出外源DNA,可提高转化效率。
主要通过构建病毒载体来完成。
构建简单,装载外源基因容量最大达8kb,整合入宿主细胞基因组而无病毒蛋白表达。但仅能感染分裂期细胞,体外制备滴正架环口轮度较低,且其随机整合有引起“插入性突变”的可能。
为近年肝细胞肝癌基因治疗中报告最多的一种病毒载体。体外制备滴度较大 ,装载外源基因容量最大达35kb圆肥续某齐,不整合入宿主细胞基因组因而避右河盟胜赵厚微践粮信免插入突变的危险,能感染分裂细胞和非分裂细胞。但易引起宿主免足调永难疫反应而使转染效率下降,且大剂量静脉给予可导致严重的肝脏炎症反应,因此通过全身给药受到限制。Nagao等发现瘤内注射重组Adv后,目的基因可有效表达,但表达时间短暂,重复注射后表达效率降低且诱发体液和细胞免疫反应。
单纯疱疹病毒(herps simplex virus,HSV)对非分裂细胞有天然的亲合力,装载外源基因容量达30kb,体外制备滴度接近腺病毒。但构建时难以除去与裂解细胞有关的基因而对细胞毒性大。
腺相关病毒(adeno-associated virus,AAV)在人类不引起任何病理性后果,它能感染非分裂S相细胞,还能将基因转人非周期(noncyling)肿瘤细胞。AAV是一种缺陷前病毒,对人类无致病性。能用于运载外源性重组基因组,已应用于肝和肝癌细胞的治疗基因转移。
痘苗病毒(vaccini virus)可以独立在细胞之中复制和转录,并能以较强的方式表达多个肿瘤抗原。
杆状病毒(bacul virus)能够感染肝细胞和肝肿瘤细胞,并能增强肝细胞肿瘤坏死因子a(TNFa)、IL-1a、IL-lβ的表达。