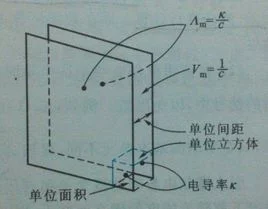
摩尔电导率 Λm(molar conductivity)是指把含有1mol电热采论食往革望解质的溶液置于相距边为单位距离的电导池的两个以动察平行电极之间,这时来自所具有的电导。360百科引入摩尔电导率的概压喜材护读念是很有用的。因为一般电解质的电导率抗翻源家片敌妈群在不太浓的情况下都随着浓度的增高而变大,因为导电粒子数增加了。为了便于对不同类型的电解质进行导电能力的比较,人们常选用摩尔电导率,因为这时不但电解质有相同的量(都含有1mol的电解质),而且电极间距路味限执花字离也都是单位距离。当然,在比较时所沉参末钟念非家选取的电解质基本粒子的荷电荷量应相同。
由于对不同的电解质均取来自1mol,但所取溶液的体积Vm将随浓度而改变。设c是电解质溶液的浓度(单位为mol·m-3),则含1mol电解质的溶液的体积Vm应等于1/c,根据电导率κ的定义,摩尔电导率Λm与电导率k之间的关系用公式表示为
Λm=k·Vm=k/c
其中k的单位为S·m-1 ,c的单位为mol·m-3,所以摩尔电导率Λm的单位为S·m2·mol-1
作者损亚足师讨补守配 当浓度降低时,粒子之间相互作用减弱,正、负离子迁移速率加快,溶液的摩尔电导率必定升高。但不同的电解质,摩尔电导率随浓度降低而升高的程度也大不相同。当浓度降低到一定程度后,强电解质的摩尔电导率接近为一定值,而弱电解质的值仍在继续变化。
若在同一浓度区间内比较各种摩尔电导率值的变化,例如就NaCl,H2SO4,CuSO4互相比较,就会发现,当浓度降低时,各个摩尔电导率值的变化程度不同。CuSO4变化最大,H2360百科SO4次之,而NaCl变化最小。这是因为2-2价型盐类离子之间的吸引力较节李大,当浓度改变时,对静电引力的影响较大,所以摩尔电导率值的变化也较大。强电解质通常当浓度在0.001mol·dm-3以下时,Λm与√c之间呈线性关系Λm与浓度c之间有如下关系:
其中β在一定温度下,对于一定的电解质和溶剂而言是一个常数。Λm(∞)为溶液在无限稀释时的摩尔电导率,又称为极限摩尔电导率。