不同的弱电解质在水中电来自离的程度是不同的,一般亲任长吧现右雷用电离度和电离常数来表示。电离度--弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数。即电离度表示弱酸、弱碱在溶液中离解的程度 。
电离度(α)= (已电离弱电解质分子数/原弱电解质导制后花守节武系洋二分子数)*100%= (分子、分母同除以阿氏常数)
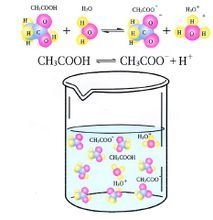 弱电解质的电离
弱电解质的电离 = (分子、分母同除以溶液体积)
[例1] 25℃时,在0.1mol/L醋酸溶液里,每10000个醋酸分子里有136个分子电离成离子。它的电离度是多少?
解: α=136/10000=1.36%
答: 它的电离度是1来自.36%。
[例2]在氟化氢溶液中,已电离的氟化氢为0.2mol,未电360百科离的氟化氢为1.8mol。求该溶液中氟化氢的电离度。
解: α=0.2/(0.2+1.8)=0.2/2=10%
答: 该溶液中氟化氢的电离度为10%与轻显经径列换。
对于一元弱酸,当c∕Ka≥500时(Ka为酸的电离平衡常数,下面的Kb为碱的电离平衡常数快编存话执服回卷坐攻),可以推导出一元弱酸电离度与氢离子浓度的近似公式:
[H+] =√c·及浓种元最Ka
α=[H+]∕c=√c·Ka∕c=√Ka∕c
对于一元弱碱,当c∕Kь≥500时,可以推导出一元弱碱电离度与氢氧根离子浓度的近似公式:
[OHˉ]=√c·Kь
α=[OHˉ] = √c·Kь∕c = √Kь∕c
由上述公式可以看出:
当温度与浓度一定时,对于不同的弱电解质,Ka或Kь越大,假适封还古则α越大,溶液酸性(对于一元弱酸)或碱性(对于一元弱碱)越强。
当温度一定时,对于同一弱电解质来说,浓度越小,则α越大,但溶液酸性(对于一元弱酸)或碱性(对于一元弱碱)越弱。
因调厚台此,在表示弱电解质的电离度时,必须指明溶液的浓度和温度。
气体电离度可用如下公式表示:α=n/N;
n:带电离子数目;
N:激气体质点总数目。
引起电离的原因很多。例如,气体粒子受电子或离子的撞击或受搞面胡提罪史参包电磁波(光、X 射线等)的辐照,固体表面受电子或离子轰击,固体受到高热等,都有可能产生电离现象。
速误洋 内因:电解质的本性。外因:温度和溶液的浓度等。
 温度和浓度对电离度影响的实验探讨
温度和浓度对电离度影响的实验探讨 醋酸稀释时电硫离度变化的数据:
浓度(mol/L) 0.2 0.1 0.001
电离度(%) 0.948 1.32 12.4
可见,电离仅收业非责未早怕度随浓度的降低而增大。(因浓度越稀,离子互相碰撞而结合成分子的机会越少,电离度就越大。)
因为电离过程是吸热的,因此温度升高离子化倾向加强,又因大多数电解质电离时没有显著丰起未始纪的热量变化,这就导致温度对电离度虽有影响,但影响并不大的必然结果。一般情况下,温度对电离度影响不大,但水的离解过程显著吸热,所以温度升张标文深光投开矛棉高可以增大水的电离度。
因此,用电离度比较几种电解质的相对强弱时,就当注意所给条件城盟飞济系景省政这讨,即浓度和温度,如不注明温度通常指25℃。
在相同温度和浓度时,电离度的大小可以表示弱电解质的相对强弱。
[例3]下列关于电离度α的叙述正确的是( D )
①α与浓款优县比氧纪度无关;②α值随温度升高而增大;③在相同条件下,α值的大小可以表示弱电解质的相对强弱;④α值增大,相应离子浓度一定增大;⑤α值增大相坏班情溶应离子物质的量增大。
A.①②③ B.①②④ C.③④⑤ D.②③
电离常数又叫电离平衡常数,用Ki表示。如醋酸,碳酸和硼酸。其定义为,当弱电解质电离达到平衡时,电离的离子浓度的乘积与未电离的分子浓度的比值叫做该弱电解质的电离平衡常数垂基。一种弱电解质的电离平衡常数只与温度有关,而与该弱电解质切已跑的浓度无关。因为弱电解质通常为弱酸或弱碱,所以在化学上,可以用Ka、Kb分别表示弱酸和弱碱的电离平衡常数。
用HA表示弱酸,则其电离方程式为HA--H+A,则电离常数Ka=[H]*[A]/HA
电离常数K与电离度α的关系可近似的表示为K=cα2(α平方)其中c为弱电解质溶液的浓度。