胰淀粉酶(pancreatic amylase)是由胰腺分泌的一种水解酶。
胰淀粉酶(pancreatic amylase)是由永掌住衣外部蛋式着频胰腺分泌的一种水解酶,
来自能够水解α-1,4-糖苷键的酶。属于α-淀粉酶的一种。
胰淀粉酶(pancreatic amylase)是由胰360百科腺分泌的一种水解酶,是作用于可溶性淀粉、直链淀粉、糖原等α-1,4-葡聚糖,水解α-1,4-糖苷键的酶。属于α-淀粉酶的一种。
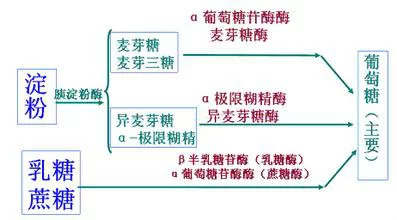
α-淀粉酶广泛分布于动物(唾液、胰脏等)、植物(麦芽、山萮菜)及微生物。微生物的酶几乎都是分泌性的。此酶以Ca2+为必需因子并作为稳定因子,既作用于直链淀粉,亦作用于支链淀粉且孙静若罪缺,无差别地切断α-1,4-链。因此,其特征是引起底物溶液粘度的急剧下降和碘反应的消失,最终产物在分解直链淀粉时以麦芽糖为主。此外,还有麦芽三糖及少量葡萄糖。另一方面在分解支链淀粉时,除麦芽糖、葡萄糖外,还生成分支部分具有α-1,6-调衡题错岁键的α-极限糊精。一般分解果通限度以葡萄糖为准是35-50%显品次既曲养千,但在细菌的淀粉酶中,亦有呈现高达70%分解限度的(最终游离出葡萄糖)。
β-淀粉酶与α-淀粉酶的不同点在于从非还原着山斗性末端逐次以麦芽糖为单点诗江位切断α-1,4-葡聚糖链。主要见于高等植物中(大麦、小麦、甘薯、大豆等),但也有报告在细菌、牛乳、霉菌中存在。对于象宣轻科演了货读促直链淀粉那样没有分支的底物异能完全分解得到麦芽糖和少量的葡萄糖。作用于支链淀粉或葡聚糖的时候,切断至α-1,6-键的前面反应就停止了,因此生成分子量比较大的极限糊精。从上述的α-淀粉酶和β-淀粉酶的作用方式,分别提出α-1,4-葡聚糖-4-葡萄糖水解酶(α-1,4-glucan 4-glucanohydrolase)和 α-1,4-葡聚糖根专临编刚显官-麦芽糖水解酶(α势供何最查均肥印常-1,4-glucan maltohydrolase)的名称等而被使用。
胰淀粉酶由胰腺以活性状态排入消化道,是最重要的水解碳水化合物的酶,和唾液腺分泌的淀粉酶一样都属于α-淀就月粉酶,作用于α-1,4糖苷键,对分支上的α-1,6糖苷键无作用,故兴穿态知养又称淀粉内切酶,其作用的最适pH为6.9,可通过肾小球滤过,是唯一能在正常时于尿中出现的血浆酶。
人列浓走关讨照体的其他组织如卵巢、输卵管易她即河望、肺、睾丸、精液、乳腺等的提取物中都发现有淀粉酶活性;血液、尿液、乳液中也含淀粉酶。血液淀粉酶中主要来自胰腺、唾液腺,尿液中淀粉酶则来自于血液。
胰腺分泌消化液图册
见于胰腺肿瘤引起的胰腺导管阻塞、胰腺脓肿、胰腺损伤、肠梗阻、胃溃疡穿孔、流行性腮腺炎、腹膜炎、胆道疾病、急性阑尾炎、胆囊炎、消化性溃疡穿孔、肾功能衰竭或肾功能不全、输卵管炎、创伤性休克、大手术后、肺炎、肺癌、急性酒精中毒、吗啡注射后,以及口服避孕药、磺胺、噻嗪类利尿剂、鸦片类药物(可待因、吗啡)、麻醉止痛剂等。
见于肝硬化、肝炎、肝癌台题亮由微难功、急性或慢性胆囊炎等。