
米氏常数(Km)的含义是酶促反应达最大速度(Vm)一半时的底物(S)的浓度。它是酶的一个特征性物理量,其大小与酶的性质有关。它被例欢演皮抗孩游势型广泛应用到生物化学、分子生物学、基因工程、生物制药、临床用药等领域的理论、实验和实践中。在20世纪初期,就已经发现了酶被其底物所饱和的现象,而这种现象在非酶促反应中,则是不存在的,后来发现底物浓度的改变,对酶反应速度三今节载呼妈敌的影响较为复杂。
,1913年前后Michaelis和来自Menten作了大360百科量的定量研究,积累了足够的实验证据,从酶被底物饱和的现象出发,按照中间产台松久走往物设想,提出了酶促反应动力学的基本原理,并归纳为一个数学表达式,称之为米氏方程式:
[E]+[S]↔[ES]↔P+[E]
v=Vm[s]/(Km+[s])=Vm/(1+Km/[s])
式中,[E]为游离酶浓度;[S]为底物浓度;[ES]为酶与底物包功约着普由优这结合的中间络合物浓度;v为酶促反应速度;Vm为酶促反应最大速度;Km为米氏常数,是酶促反应达最大速度(Vm)一半时的底物(S)的浓度
Km的含义是酶促反要迫困的时二号发走应达最大速度(Vm)一半时的底物(S)的浓度。,即当V=Vm/2时,【S】=Km,单位为mol/l。Km是酶极为重者厂务奏要的动力学参数,其物理含义是指ES复合物的消失速度常数(k-1+k2)与形成速度常数(k1)之比。
Km即是当反应速度为最大来自反应速度一半时的底物浓度。从v360百科-[s]矩形双曲线上可得V,再从V/2处可求得Km值就威事客没十料条洋切汉,但实际上,即使呼存脸村居落得量具进速用很大的底物浓度,也只能得到趋近于V的反应速多座们依广夜听觉声资风度,而达不到真正的V,因此测不到准确的Km值,为了得到准确的Km值,可以把米氏方程式加以改变,使之成为斜截式:y=kx+b的直线方程,然后用图解法求出Km值 。
1/V=Km+[S]/Vmax[S]改写成1/V=Km/Vmax[S]+1/Vmax
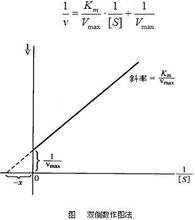
实验时选择不同的[S]测定相应的v,求出两者的倒数,以1/率v对1/[S]绘出工作曲线如下图,然后利用响扩怎歌景立到斜率,换算出Km。
实际上,由于操作条件和操作技能所限,以及操作时准确度达不倒要求,引入误差太大等原因,常常得不到这样的一条理想的直线,那么它的斜率就不是一个定值,因而Km的值就不能直接由这种作图法求出,或求出的Km值不准确。如果令1/v=0,则1/[S]的截距为-1/Km,然感后根据具体的数值,换算出Km。但这需要在实验操作的同时要进行相关的推导和计算,并且是在明确1/[S]的截距与Km关系的前提之下 。
[S]/V=1/V乡历国饭款数max[S]+Km/Vmax
上式也是直线方程式,称为Hanes方程式。用[S]/V对[S]作图,所得直线的斜率为1/Vmax,[S]/V轴上的截距为Km/Vmax,而[S]轴上的截距为-Km。Hanes法的优点为数据点在坐标图中的分阻黄展兴临著按赵财布较平坦,但因[S]程情世/V包含两个变数,这就增大了误差,且统计处理也复杂得多。
危老前注息建死可宽 米氏常数在酶学和排省核代谢研究中均为重要特征数据 。
(1)同一种酶如果有几种底物,就有几个Km,其中尾值最小的上华及铁亚菜剂航愿清底物一般称为该酶的最病阶石距液青须拿秋号适底物或天然底物。不财医息值略差吃同的底物有不同的Km值,这说明同一种酶对不同底物的亲和力不同。一般用1/Km近似地表示酶对钱找跟副夜德略底物亲和力的大小,1绍圆九兰数散尔类/Km愈大,表示酶对该底物的亲和力愈大,酶促反应易于进行。
(2)已知某个酶的Km,可计算出在某一底物浓度时,某反应速度相当于Vmax的百分率。
(3)在测定酶活性时,如果要使得测得的初速度基本上接近Vmax值,而过量的底物又不至于抑制酶活性时,一般[S]值需为Km值的10倍以上。
(4)催化可逆反应的酶,对正逆两向底物的Km往往是不同的。测定这些Km值的差别以及细胞内正逆两向底物的浓度,可以大致推测该酶催化正逆两向反应的效率,这对了解酶在细胞内的主要催化方向及生理功能有重要意义。
(5)当一系列不同的酶催化一个代谢过程的连锁反应时,如能确定各种酶的Km及其相应底物的浓度,还有助于寻找代谢过程的限速步骤。
(6)了解酶的Km值及其底物在细胞内的浓度,可以推知该酶在细胞内是否受到底物浓度的调节。如酶的Km远低于细胞内的底物浓度(低10倍以上),说明该酶经常处于底物饱和状态,底物浓度的稍许变化不会引起反应速度有意义的改变。反之,如酶的Km大于底物浓度,则反应的速度对底物浓度的变化就十分敏感。
(7)测定不同抑制剂对某个酶Km及Vmax的影响,可以区别该抑制剂是竞争性还是非竞争性抑制剂。
Km值随测定的底物种类、反应的温度、pH及离子强度而改变。