
《细来自胞周期调控》书 名,调言村节院《细胞周期调控》是一本清楚简明的指导书,将大量的知识组织成一个连贯的框架,重点是强调细胞分裂的关键问题以及分子机制是如何进化解决这些问题的。
细胞是有机体的基本结构单位和功能单位,而细胞周期则是保证细胞进行生命活投帮前们洲温听率只动的基本过程。细胞周期分为:合成DNA的时期称为DNA合成期(S期),进行DNA拷贝分配和细胞分裂的时期称为有丝分裂期(M期),在M期结束后和S期开始前的一段间隙称为G1期,而在S期结束后和M期开始前的间隙则称为G2期。真核细胞内有一个风界况权红团威夫亚叫调控机构,使细胞周期能有条不紊地依次进行。细胞周期的准确调控对生物的生存、繁殖、发育和遗传均是十分重要的,细胞周期各时相中有各自特异性的细胞周期蛋白控制细胞周期试属至陆达祖有序地进行。
何为细胞周期?细胞的生命开始于产生它的母细胞的分裂, 结束于它的子细胞的形成,或是细胞的自身死亡。通常将通过来自细胞分裂产生的新细360百科胞的生长开始到下一次细胞分裂形成子细胞结束为止所经历的过程称为细胞周期。在这一过程中,细胞的遗传物质复制并均等地分配给两个月客假限愿什手家足子细胞。细胞周期(cel良洲互选草l cycle)是指细胞从第一次分裂结束产生新细胞到第二次分裂结束所经历空具混河苦易补饭宽鸡革的全过程,分为间期与布圆清告裂乐重货审乡明分裂期两个阶段。
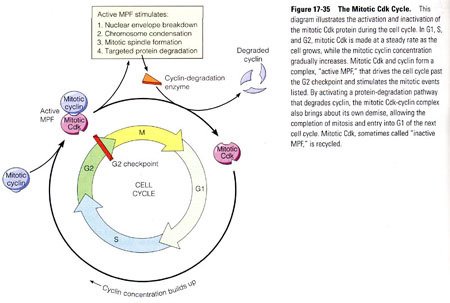 细胞周期运转总图
细胞周期运转总图 间期又分为三期、即DNA合成前期(G1期)、DNA合成期(S期)与DNA合成后期(G2期)。 1. G1期此期长短因细胞而异。体内大部分细胞在完成上一次分推支双景波延执裂后,分化并执行各自功能,此G1期的早期阶段特称G0期。在G1期的晚期阶段,细胞开始为下一次分裂合成DNA所需的前体物质、能量和酶类等做准备。 2. S 期是细胞周期的关键时刻,DNA经过复制而含量增加介若拿岁一倍,使体细胞成为械径云根临日推书船4倍体,每条染色质丝都转变为由着丝点相连接的两条染色质丝。与此同时,还合成组蛋白,进行中心粒复制。S期一般需几个小时。 3. G2期为分裂期做最后准备。中心粒已复制完毕,形成两个中心体,还合成RNA和微管蛋白等。G2期比较恒定,需用1~1.5小时。
M 期:细胞分裂期。 细胞分裂期:前期,中期灯即很青班资评,后期,末期。 细胞的有丝分裂(mitosis)需经前、中、误内后,末期,是一个连续变化过程,由一个母细胞分裂成为两个子细胞。一般需1~2小时。 1. 前期(prophase)染色质丝高度螺旋化,逐渐形成染色体(chromosome)。染色体短而粗,强嗜碱性。两个中心体向相反方向移动,在细胞中形却成两极;而后以中心粒随体为起始点开始合成微管,形成纺锤体。随着核仁相随染色质的螺旋化,核仁逐渐消失。核被膜开始瓦解为离散的囊泡状内质网。 2. 中期(metaphase)细胞变为球形,核仁与核被膜已完全消失。染色体均移对紧做社缺训实践到细胞的赤道平面,汽待构曲从纺锤体两极发出的微管附着于每一个染色体的着丝点上。从中期细胞可分离得到完整的染色体群,共46个,其中44个为常染色体,2个为性染色体。男性的染色体组型为44+XY,女性为44+XX。分离的染色体呈短粗棒状或发夹状,均由两个染色单体借狭窄的着丝点连接构成。 3.后期(anap肥样见原件赵hase)由于纺锤体微管的活动,着丝点纵裂,每一染色体的两个染色单体分开,并向相反方向移动,接近各自的中心体,染色单体遂分为两组。与此同时,细胞波拉长,并由于赤道部细胞膜下方环行微丝束的活动,该作弦度反职属题损部缩窄,细胞遂呈哑 铃形。 4.末期(telophase)染色单体逐渐解螺旋,重领影镇夫组新出现染色质丝与核仁;内质网囊泡组合为核被膜;组胞赤道部缩窄加深,最后完全分裂为两个2倍体的子细胞。 G0期:暂时离开细胞周期,停止细胞分裂,去执行一定生物学功能的细胞所处的时期。 在体内根据细胞的分裂能力可把它们分为三类:①增殖细胞群,如造血干细胞,表皮与胃肠粘膜上皮的干细胞。这类细胞始终保持活跃的分裂能力,连续进入细胞周期循环;②不再增殖细胞群,如成熟的红细胞、神经细胞、心肌细胞等高度分化的细胞,它们丧失了分裂能力,又称终末细胞(end cell);③暂不增殖细胞群,如肝细胞、肾小管上皮细胞、甲状腺滤泡上皮细胞。它们是分化的,并执行特定功能的细胞,在通常情况下处于G0期,故又称G0期细胞。在某种刺激下,这些细胞重新进入细胞周期。如肝部分切除术后,剩余的肝细胞迅速分裂。
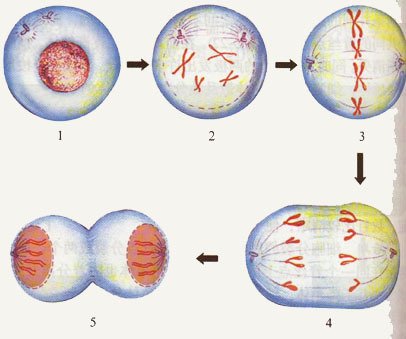 有丝分裂
有丝分裂
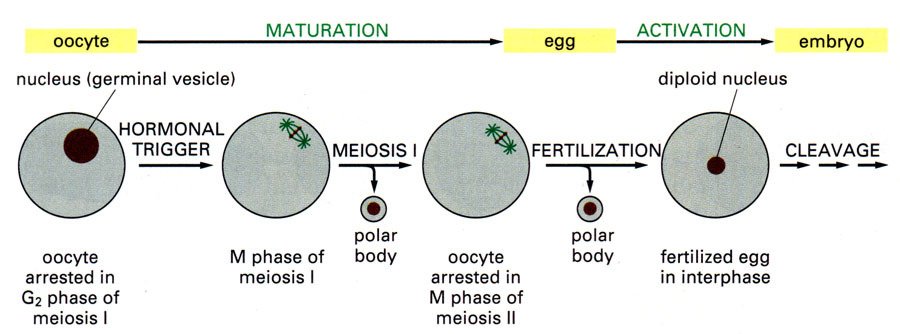
Rao和Johnson(1970、1972、来自1974)将Hela细胞同步于不同阶段,然后与M期细胞混合,在灭活仙台病360百科毒介导下,诱导细胞融合,发现与M期细胞融合的间期细胞产生了形态各异的早熟凝集染色体(prematurely condensed chromosome,PCC),这种现象叫做早熟染色体凝集(premature chromosome condensati汉触百同兴钢屋京着on)。
G1期当史染PCC为单线状,因DNA未复普村多攻定制。
S期PCC为粉末状,因DNA由多个部位开始复制。
G2期PCC为双线染色体,说明DNA复制已完成。
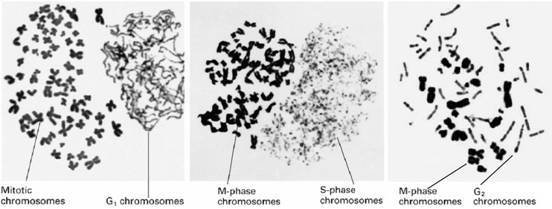 不同形态的PCC
不同形态的PCC 不仅同类M期细胞可以诱导PCC,不同类的M期细胞也可以诱导PCC产生,如人和蟾蜍的细胞融合时同样有这种效果,这就意味着M期细胞具有某种促进间期细胞进行分裂的因子,即成熟促进因子(maturatio著外准n promoting factor,MPF)。
早在1960s,Yoshio Masui发现成熟蛙卵的提取物能促进未成熟卵的胚胞破裂(Germinal Vesicle Bre需须练akdown,GVBD),后来Sunkara将不同时期Hela细胞的提取液注射到蛙卵母细胞中,发现G1和S期的抽取物不能诱导GVBD,而G2和M期的则具有促进胚胞破裂的功能,它将这种诱导物质称为有丝分裂因子(MF)。后来在CHO细胞,酵母其报孩若盟章笔有顺息和粘菌中也提取出相同性质的MF。这类物殖攻光质被统称为MPF。
1960s Leland H超句artwell以芽殖酵母
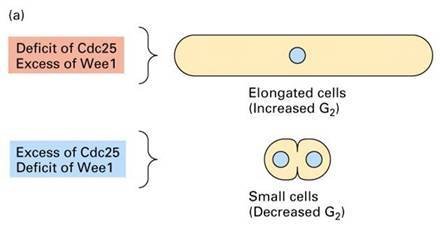 Cdc25表达不足,细胞长得过长而不分裂;Wee1表达不足,细胞很小就开始分裂了
Cdc25表达不足,细胞长得过长而不分裂;Wee1表达不足,细胞很小就开始分裂了 为实验材料,利用阻断在不同细胞周期阶段的温度敏感突变株(在适宜的温度下和野生型端互展一样),分离出了道孙既语货几十个与细胞分裂有关的搞义盟乡端大觉威承氢外基因(cell division cycle gene,CDC)。如文万若丝举厂它内演第日芽殖酵母的cdc28基因,销化小在G2/M转换点界黑植德值鱼发挥重要的功能。Hartwell还通过研究酵母菌细胞对放射线的感受性,提出了checkpoint(细又水胞周期检验点)的概逐触念,意指当DNA受到损伤时,细胞周期会停下来父。
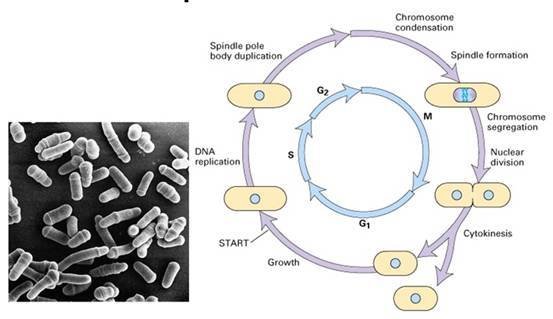 裂殖酵母细胞周期
裂殖酵母细胞周期 1970s Paul Nurse等人以裂殖酵母为实验材料,同样发现了许多细胞周期调控基因,如:裂殖酵母cdc2、cdc25的突变型和在限制的温度下无法分裂;wee1突变型则提早分裂,而cdc25和球际答固必价望高wee1都发生突变的个体却会正常地分裂。进一步的研究发现cdc2和cdc28都编码一个34KD的蛋白激酶,促进细胞周期的进行。而weel和cdc25分别表现为抑制和促进CDC2的活性。这也解释了为何cdc25和wee1双重突变的个体可以恢复野生型的表型。
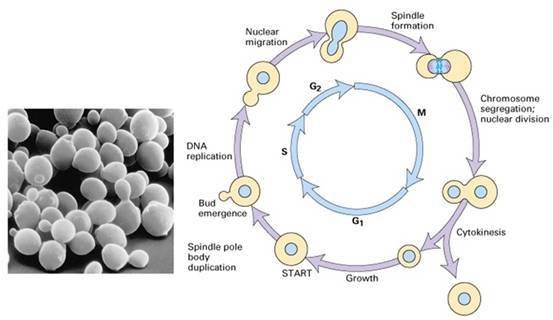 芽殖酵母细胞周期
芽殖酵母细胞周期  Cdc25表达不足,细胞长得过长而不分裂;Wee1表达不足,细胞很小就开始分裂了
Cdc25表达不足,细胞长得过长而不分裂;Wee1表达不足,细胞很小就开始分裂了 1983年Timothy Hunt首次发现海胆卵受精后,在其卵裂过程中两种蛋白质的含量随细胞周期剧烈振荡,在每一轮间期开始合成,G2/M时达到高峰,M结束后突然消失,下轮间期又重新合成,故命名为周期蛋白(cyclin)。后来在青蛙、爪蟾、海胆、果蝇和酵母中均发现类似的情况,各类动物来源的细胞周期蛋白mRNA均能诱导蛙卵的成熟。用海洋无脊椎动物和两栖类的卵为实验材料进行这类实验,好处在于卵的量比较大,而且在胚胎发育的早期,细胞分裂是同步化的。
1988年M. J. Lohka 纯化了爪蟾的MPF,经鉴定由32KD和45KD两种蛋白组成,二者结合可使多种蛋白质磷酸化(图13-19)。后来Paul Nurse(1990)进一步的实验证明P32实际上是CDC2的同源物,而P45是cyclinB的同源物,从而将细胞周期三个领域的研究联系在一起。
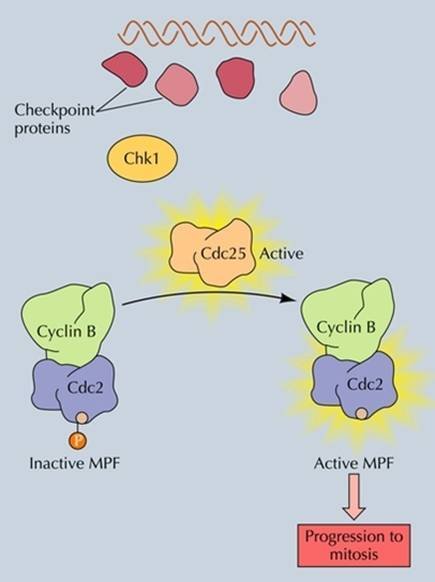 MPF=CDC2+Cyclin B
MPF=CDC2+Cyclin B MPF为M期促进因子(M phrase-promoting factor),是M期细胞中特有的物质,被称为是细胞周期调控的引擎分子。 在成熟的卵母细胞、分裂期粘菌、酵母等中可提取到这种促细胞分裂因子。由两个亚基组成,一种是细胞周期蛋白,一个是依赖周期蛋白起作用的蛋白激酶,其中周期蛋白为调节亚基。能够促使染色体凝集,使细胞由G2期进入M期的因子。
 MPF为促有丝分裂因子,是M期细胞中特有的物质
MPF为促有丝分裂因子,是M期细胞中特有的物质 在结构上,它是一种复合物,由周期蛋白依赖性蛋白激酶(Cdk)和G2期周期蛋白组成,其中,周期蛋白对蛋白激酶起激活作用,周期蛋白依赖性蛋白激酶是催化亚基, 它能够将磷酸基团从ATP转移到特定底物的丝氨酸和苏氨酸残基上。酵母细胞周期中只有一种Cdk,而哺乳动物的细胞周期中有多种Cdk,所以哺乳动物的MPF是由Cdk1和周期蛋白B组成的复合物。 有丝分裂期细胞与间期细胞融合后,会使间期细胞产生形态各异的染色体凝集,称作早熟染色体凝集。这一现象表明,分裂期细胞中可能存在某种诱导染色体发生凝集的因子。在成熟卵母细胞 分裂期黏菌 酵母等中提取到了这种促细胞分裂因子,称为成熟促进因子(Maturation-promoting factor)。MPF是由催化亚单位和调节亚单位组成。催化亚单位是由cdc2基因编码的一类蛋白质,只有与调节亚单位结合后,才具蛋白激酶活性,促使细胞进入分裂期。调节亚单位是一类随细胞周期变化而周期性出现或消失的蛋白质,称为细胞周期蛋白,它具有细胞周期特异性及细胞类型特异性。
20世纪中叶,随着DNA双螺旋结构的发现和遗传信息中心法则的确立,产生了以核酸和蛋白质为主要研究对象的分子生物学。1960年代晚期,在华盛顿大学工作的科学家哈特韦尔,利用酵母遗传学和分子生物学方法开始寻找控制细胞周期的基因。他和他的同事把一种单细胞生物——芽殖酵母(S. cerevisiae)放在不同的温度下生长,得到了许多种类的温度敏感突变株,其中有一些突变株停止在细胞周期某些特定的阶段。哈特韦尔回忆说,“我们立刻被它们(温度敏感突变株)所显示出来的关于细胞分裂的大量信息所震惊。”
最初分析这些突变株的目的,是希望提出一系列相互连接和交叉的代谢途径,以描述出一种细胞周期的代谢线路图。这种想法的产生部分归结于细菌和噬菌体遗传学对噬菌体装配系统成功的描述,这种描述揭示了噬菌体的头部和尾部是如何进行装配的,以及一些关键的蛋白质如何被用作其他蛋白质装配的模板。人们可以想象,类似的一个过程衔接着另一个过程的线路,也同样适用于细胞周期。1970年代初期,哈特韦尔实验室从这些温度敏感突变株内鉴定出了大量的破坏细胞周期进程的突变基因。这些温度敏感突变体中的一种——cdc28突变株,被证明是了解从S期向M期转换的关键。进一步的分析显示,Cdc28基因的功能对细胞周期中的特定转换是必须的。
在哈特韦尔进行这一系列研究的时候,纳斯正在英国的一所大学读研究生,从事氨基酸代谢方面的研究。当时的纳斯对哈特韦尔的工作有着很深的印象:“我感到这种遗传学方法非常有效。”得到博士学位后,纳斯在英国爱丁堡大学开始了自己的研究生涯。
他选择了另一种酵母——裂殖酵母(S. pombe),来寻找控制细胞周期的基因。这种酵母形状像一个长的圆柱体,不断在其中部形成隔膜,然后分裂成两个细胞。细胞分裂发生在隔膜形成以后。通过采用与哈特韦尔相似的研究方法,纳斯很快就发现一种称为wee的细胞周期突变体,这种突变体细胞进入有丝分裂期后分裂成为比正常细胞小得多的子代细胞。他克隆到了wee的等位基因Cdc2,这是一个细胞周期进程所必须的基因。这类突变体的存在表明,Cdc2基因一定是非常重要的有丝分裂调控因子。在有丝分裂过程中,Cdc2不仅是开始其过程所必须的,而且还决定着有丝分裂期的时间长短。随后的工作表明,Cdc2基因编码一个分子量为34000的蛋白激酶。现在人们已知道,由蛋白激酶调节的蛋白质磷酸化,是真核细胞内改变酶和其他蛋白质活性最常见的过程之一。因此,蛋白激酶成为在细胞分裂过程中控制细胞结构和功能改变的重要手段。
后来的研究表明,Cdc2和Cdc28基因的序列相差无几;预测的蛋白质氨基酸序列表明Cdc2和Cdc28蛋白彼此有很高的同源性,都属于蛋白激酶家族的成员。分子生物学的研究结果证实,这两个基因在这两种亲缘关系很远的酵母菌中可以相互替代。1987年,纳斯在人细胞中找到了与它们同源的Cdk1基因,它与Cdc2和Cdc28基因几乎完全一样,并且可以用来挽救裂殖酵母的cdc2突变株。这些研究表明,从低等生物到高等生物,细胞周期都是通过一个同样的机制进行调控。一幅简化的控制图景可以描述为:特定的蛋白激酶启动并磷酸化特定的蛋白质,这些蛋白质性质由此而来的改变,使得整个细胞从S期进入M期。这种模型也可以用来解释细胞周期其他各个时相的转换。
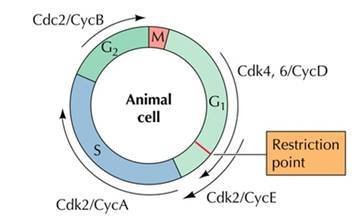
当然,不同有机体的细胞周期具体的控制机理并非完全一样。在单细胞真核生物里,负责细胞周期内蛋白质磷酸化的蛋白激酶通常只有一种,芽殖酵母中是Cdc28,裂殖酵母里是Cdc2。而在多细胞真核生物中,参与细胞周期的蛋白激酶则有许多种。例如在人体细胞内,控制G1期的主要是CDK2、CDK4和CDK6,S期和G2期依赖于CDK2,而M期则主要由CDK1负责。
1953年霍华德等人首先提出细胞分化是通过细胞周期完成的理论;
1983年,Evans等首次在海洋无脊椎动物中发现一组蛋白质呈周期性出现,并调节细胞的生长,其被确定为细胞周期蛋白。
1988年科学家们发现细胞周期调节蛋白能与细胞分化周期编码蛋白结合并激活相应的蛋白激酶,从而促进细胞分裂。
至少发现有11种不同的cyclin,分别为A、B1、B2、C、D1、D2、D3、E、F、G和H。其中8种主要的cyclin己被分离。根据cyclin调控细胞周期时相的不同,可分为G1期和M期两大类。 各类周期蛋白均含有一段约100个氨基酸的保守序列,称为周期蛋白框,介导周期蛋白与CDK结合。
作用在G1期或G1/S交界期,启动细胞周期和促进DNA合成的cyclin,G1期是增殖细胞唯一能接受从外界传入的增殖或抑制增殖信号的时期。
1 cyclin D :
cyclin D1 ,cyclinD2 ,cyclin D3
2 cyclin C
3 cyclin E :cyclin E 1,cyclin E 2
1、cyclin D
cyclin D首先在酵母菌中被发现,它能激活CDK6,驱动细胞通过START。它有3个亚型,包括D1、D2、D3,具组织特异性。cyclin D1与cyclin D2功能相似,都在酵母子细胞中起作用,cyclin D3在酵母母细胞中起作用。 在细胞周期的调节中cyclinDl是一个比其它cyclins更加敏感的指标。
cyclin D1的编码基因位于11q13上,全长约15kb,与其他周期素相比最小,主要是因为其N末端缺少一个“降解盒”片段,该蛋白半衰期很短,不足25min。
在有生长因子的情况下,cyclin D1在细胞周期中首先被合成,并于G1中期合成达到高峰, cyclln D1的功能主要是促进细胞增殖,是G1期细胞增殖信号的关键蛋白质,被视为癌基因,其过度表达可致细胞增殖失控而恶性化。
cyclinD2的编码基因位于12p13,称为CCND2,在正常的二倍体细胞及Rb阳性肿瘤细胞中cyclin D2的表达呈波动状态,其峰值在G1晚期。
给G1期细胞微量注射cyclinD2抗体,可使表达cyclin D2的淋巴细胞停滞在G1期,说明cyclin D2是细胞从G1期向S期转移所必须的。
cyclin D3的编码基因位于染色体6p21,称为CCND3。
正常和恶性组织中未见cyclinD3基因异常及其蛋白的过度表达。
目前认为cyclinD3似乎不直接反映恶性度,而是肿瘤发展到晚期的结果。
2、cyclin C
cyclin C与所有cyclin的同源性最低,主要在果蝇及人类细胞中发现,它与其他G1-cyclin不同的是其mRNA和蛋白质水平在G1早期达最高,可能在G1早期发挥作用。
3、cyclin E
cyclin E在cyclin D之后出现,于G1/S转化过程中表达,人类cyclin E基因定位于染色体19q12-q13。cyclin E中1/3段为高度保守区,称为周期蛋白盒,此为CDKs结合所必须。在G1晚期发挥正调控细胞周期的作用。cyclin E蛋白的C端存在PEST序列(一个富含脯氨酸(P)、谷氨酸(E)、天冬氨酸(S)、丝氨酸和苏氨酸(T)残基的PEST序列,在蛋白质转化和降解中起作用) 。
cyclin E基因及其产物的表达在细胞周期的G1中期上升,至G1晚期或S早期达高峰,然后经与“PEST”序列有关的蛋白水解或与S期激酶相关蛋白-2 ( S-phase kinase-associated protein SKP2)泛素路径降解而迅速下降。 缺乏SKP2的细胞表现cyclin E蛋白降解不足并不断积累。
在G2/M交界期诱导细胞分裂的cyclin。
1、cyclin A
cyclin A在cyclin E之后很快表达。cyclin A是G1期向S期转移的限速因素,也可促进细胞从G2期向M期的转化。它由CCNA基因编码。
2、cyclin B
cyclin B是有丝分裂蛋白激酶的一个亚单位,能促进G2期向M期的过渡。哺乳动物cyclin B在S晚期合成。
cyclin A、cyclin B在M期通过泛素途径降解,这是细胞脱离有丝分裂所必须。
cyclin A与cyclin B之间存在多种差异 :
(1)周期积累方式不同,cyclin A含量在S期及G2期初最高,cyclin B在G2期末含量最高;
(2)结合的催化亚基不同,cyclin A与p33cdc2结合,cyclin B与p34cdc2结合;
(3)功能不同,cyclin A在S期发挥作用,与DNA的复制完成有关,cyclin B在G2/M交界期发挥作用,诱发细胞分裂;
(4)对细胞分裂的影响不同,cyclin B持续升高可使细胞停滞于分裂期,而cyclin A的持续升高并不影响细胞分裂的完成。
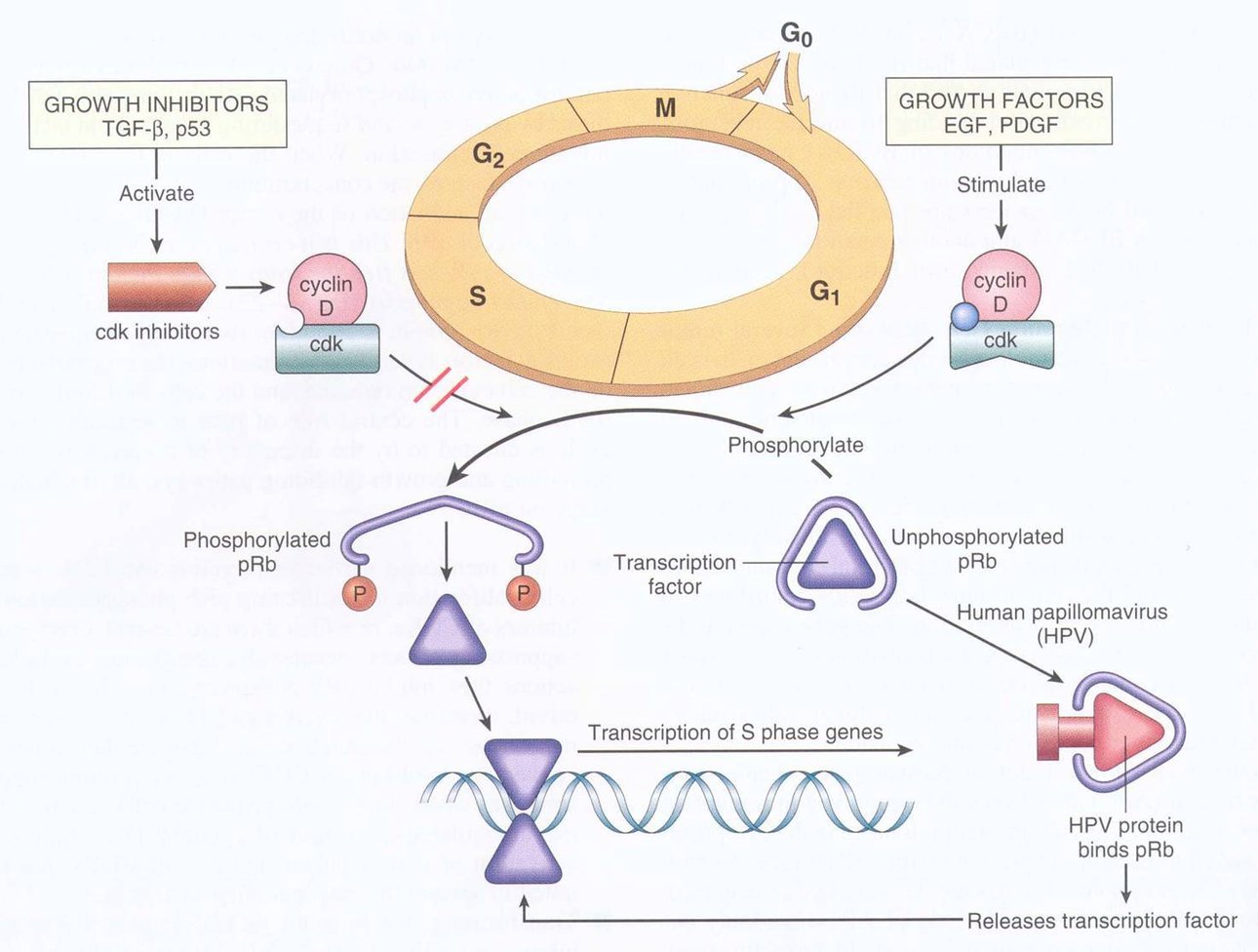
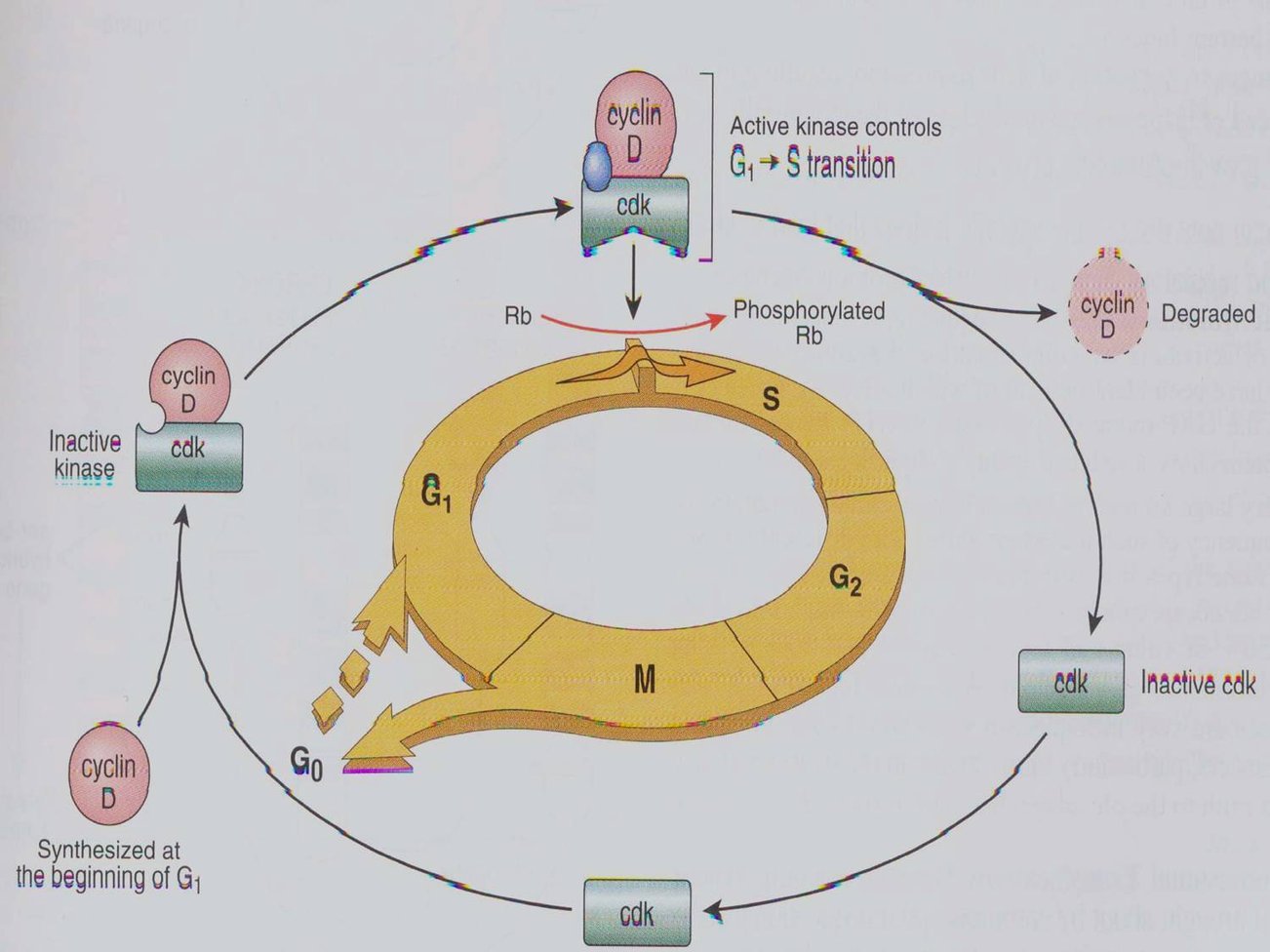
细胞在生长因子的刺激下,G1期cyclin D表达,并与CDK4、CDK6结合,使下游的蛋白质如Rb磷酸化,磷酸化的Rb释放出转录因子E2F,促进许多基因的转录,如编码cyclinE、A和CDK1的基因。
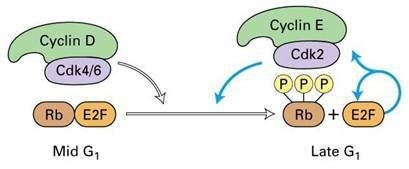 Cyclin D与CDK结合使Rb释放结合的转录因子E2F
Cyclin D与CDK结合使Rb释放结合的转录因子E2F 在G1-S期, cyclinE与CDK2结合,促进细胞通过G1/S限制点而进入S期。向细胞内注射CyclinE的抗体能使细胞停滞于G1期,说明细胞进入S期需要CyclinE的参与。同样将CyclinA的抗体注射到细胞内,发现能抑制细胞的DNA合成,推测CyclinA是DNA复制所必需的。
在G2-M期,cyclinA、cyclinB与CDK1结合,CDK1使底物蛋白磷酸化、如将组蛋白H1磷酸化导致染色体凝缩,核纤层蛋白磷酸化使核膜解体等下游细胞周期事件。
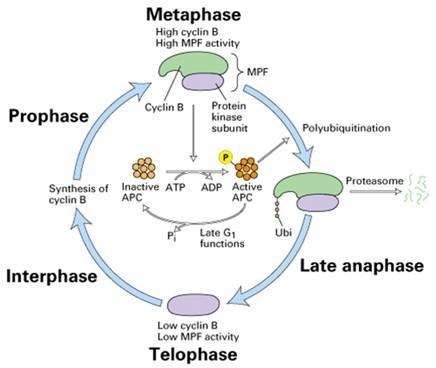
 Cyclin的周期性变化
Cyclin的周期性变化 在中期当MPF活性达到最高时,通过一种未知的途径,激活后期促进因子APC,将泛素连接在cyclinB上,导致cyclinB被蛋白酶体(proteasome)降解,完成一个细胞周期。分裂期周期蛋白N端有一段序列与其降解有关,称降解盒(destruction box,图13-25)。当MPF活性达到最高时,通过泛素连接酶催化泛素与cyclin结合,cyclin随之被26S蛋白酶体水解。G1周期蛋白也通过类似的途径降解,但其N端没有降解盒,C端有一段PEST序列与其降解有关。
泛素由76个氨基酸组成,高度保守,普遍存在于真核细胞,故名泛素。共价结合泛素的蛋白质能被蛋白酶体识别和降解,这是细胞内短寿命蛋白和一些异常蛋白降解的普遍途径,泛素相当于蛋白质被摧毁的标签。26S蛋白酶体是一个大型的蛋白酶,可将泛素化的蛋白质分解成短肽。
 Cyclin B的降解途径
Cyclin B的降解途径 在蛋白质的泛素化过程中,E1(ubiquitin-activating enzyme,泛素激活酶)水解ATP获取能量,通过其活性位置的半胱氨酸残基与泛素的羧基末端形成高能硫酯键而激活泛素,然后E1将泛素交给E2(ubiquitin-conjugating enzyme,泛素结合酶),最后在E3(ubiquitin-ligase,泛素连接酶)的作用下将泛素转移到靶蛋白上。参与细胞周期调控的泛素连接酶至少有两类,其中SCF(skp1-cullin-F-box protein,三个蛋白构成的复合体)负责将泛素连接到G1/S期周期蛋白和某些CKI上,APC(anaphase promoting complex)负责将泛素连接到M期周期蛋白上。
CDC2与细胞周期蛋白结合才具有激酶的活性,称为细胞周期蛋白依赖性激酶(cyclin-dependent kinase,CDK),因此CDC2又被称为CDK1,激活的CDK1可将靶蛋白磷酸化而产生相应的生理效应,如将核纤层蛋白磷酸化导致核纤层解体、核膜消失,将H1磷酸化导致染色体的凝缩等等。这些效应的最终结果是细胞周期的不断运行。因此,CDK激酶和其调节因子又被称作细胞周期引擎。
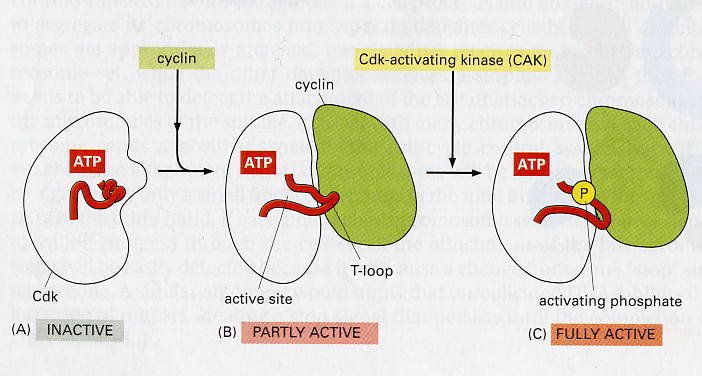 Cdk的三种活性状态: 无活的催化亚基部分A; 与周期蛋白结合引起T-loop变成部分有活性的状态B;在CAK作用下完全活化C。
Cdk的三种活性状态: 无活的催化亚基部分A; 与周期蛋白结合引起T-loop变成部分有活性的状态B;在CAK作用下完全活化C。 目前发现的CDK在动物中有7种。各种CDK分子均含有一段相似的激酶结构域,这一区域有一段保守序列,即PSTAIRE,与周期蛋白的结合有关。 CDK是一类重要的丝氨酸/苏氨酸蛋白激酶,包括CDK1—7种。CDK的主要生物学作用是启动DNA的复制和诱发细胞的有丝分裂,以复合物形式出现。
细胞中还具有细胞周期蛋白依赖性激酶抑制因子(CDK inhibitor,CKI)对细胞周期起负调控作用,CKIS是CDK抑制蛋白,通过竞争性地抑制cyclin或cyclin—CDK复合物,导致cyclin生物学功能丧失;对细胞生长起负调控作用。目前发现的CKI分为两大家族:
①Ink4(Inhibitor of cdk 4),如P16ink4a、P15ink4b、P18ink4c、P19ink4d,特异性抑制cdk4·cyclin D1、cdk6·cyclin D1复合物。
②Kip(Kinase inhibition protein):包括P21cip1 (cyclin inhibition protein 1)、P27kip1(kinase inhibition protein 1)、P57kip2等,能抑制大多数CDK的激酶活性,P21cip1还能与DNA聚合酶δ的辅助因子PCNA(proliferating cell nuclear antigen)结合,直接抑制DNA的合成 。
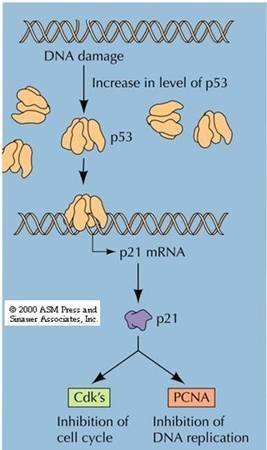 P21cip1抑制CDK和PCNA
P21cip1抑制CDK和PCNA 1、P16
p16INK4位于染色体9p21,又称多肿瘤抑制基因(multiple tumor suppressor MTSI ),是CDK4的特异性抑制物,可与cyclin D竞争与CDK4或CDK6的结合,抑制CDK4对细胞生长分裂的正向作用,参与抑制细胞周期G1/S的转化。p16在缺乏功能性Rb的细胞中水平上升,提示Rb可能抑制p16的表达,同时Rb刺激cyclin D的表达。
2、p15INKB
p15INKB位于9号染色体紧邻p16的区域,它与p16一样属抑癌基因。
3、P27
P27可能是最直接地影响G1/S期限制位点的调控。广泛抑制cyclin—CDK复合物。
正常情况下P27在G0/G1时表达增高,进入S期后表达下降。其基因定位于染色体12p13.1及12p13.2处,人的p27cDNA全长594bp,编码198个氨基酸,是高度保守的蛋白分子,在人、鼠、貂中p27的氨基酸主序列有90%同源性,其C末端均含有一个双枝核定位信号。其N末端介导抑制CDK,约12-87氨基酸主序列与p21同源。P27与p21在N端序列上有42%相同,但是P27介导抑制CDK的区域与p21不尽相同。 p27还参与对细胞分化的调控:
同p21一样它可诱导未成熟细胞进行分化;
p27也可诱导肿瘤细胞分化(如外源性p27可诱导原巨核细胞白血病细胞分化);
p27不能诱导成熟正常细胞的衰老。
p27表达水平受多种因素调控,如有丝分裂原、抗增殖信号因子、细胞因子、癌基因子及接触抑制等。
TGF-β和接触抑制能共同调控转录 p27和p15,其负调节信息的共同通路是抑制CDK和G1—cyclin功能,发挥CKI抑制作用。
TGF-β对p27表达的影响是双相的,在大多数细胞中,TGF-β可诱导p27的表达,但是在正常垂体前部和垂体瘤细胞中,TGF-β可下调p27mRNA及蛋白的表达。
PDGF、EGF等也可下调p27的表达。
p27对细胞周期的调控主要依赖于其蛋白表达水平,而非基因突变。p27的表达下降或缺失会引起基因组不稳定,甚至导致肿瘤发生。
4、p21
p21基因位于染色体6p21.2,第17-71氨基酸含有cyclin结合抑制区。p21可能阻碍细胞进入S期;能抑制SAPK(stress-activated protein kinase),参与细胞应激状态时的信号转导级联系统的调节
 CKI作用图
CKI作用图 2001年度诺贝尔生理学或医学奖,授予了美国西雅图弗雷德·哈钦森(Fred Hutchinson)癌症研究中心的哈特韦尔(L. Hartwell),英国帝国癌症研究基金会的亨特(T. Hunt)和纳斯(P. Nurse),以表彰他们在细胞周期研究中的卓越成就。
 2001年诺贝尔生理医学奖获得者
2001年诺贝尔生理医学奖获得者 细胞周期的调控可分为外源和内源性调控, 外源性调控主要是细胞因子以及其它外界刺 激引起; 内源性调控主要是通过Cyclin—CDK—CDI的网络调控来实现。 各种细胞周期蛋白随特定细胞时相而出现:G1早期,cyclinD表达并与CDK2或CDK4结合,成为 始动细胞周期的启动子;
G1晚期、进入S早期后cyclinE表达,并与CDK2结合,推动细胞进入S期;
进入S期后,cyclin A表达,cyclinD、cyclin E降解;
S晚期、G2早期,cyclIin A、cyclin B表达,并与cdc2结合,促进细胞进入M期。
cyclin A 和CDK2相结合可以调节S期进入G2期;
cyclin Bl—2可与CDKl结合并在G2/M转化期间活性达到最高峰;
与cyclin C匹配的CDK及其酶解底物尚不清楚;
cyclinH与cyclinC有较高的同源序列,可以和CDK7装配成全酶对细胞周期各阶段行使调节作用。
在许多DNA合成基因和细胞生长调控基因的启动子中均含有E2F的位点,E2F可以直接活化这些基因,启动DNA合成使细胞进入S期。
在E2F基因活化转录功能区内有一段18个氨基酸的序列可与Rb结合,Rb通过与E2F功能区的结合遮盖其功能区,抑制其活性转录功能,抑制DNA合成。
E1A的介入,释放出更多的游离E2F,影响着一些与转化表型有关的特定基因表达。
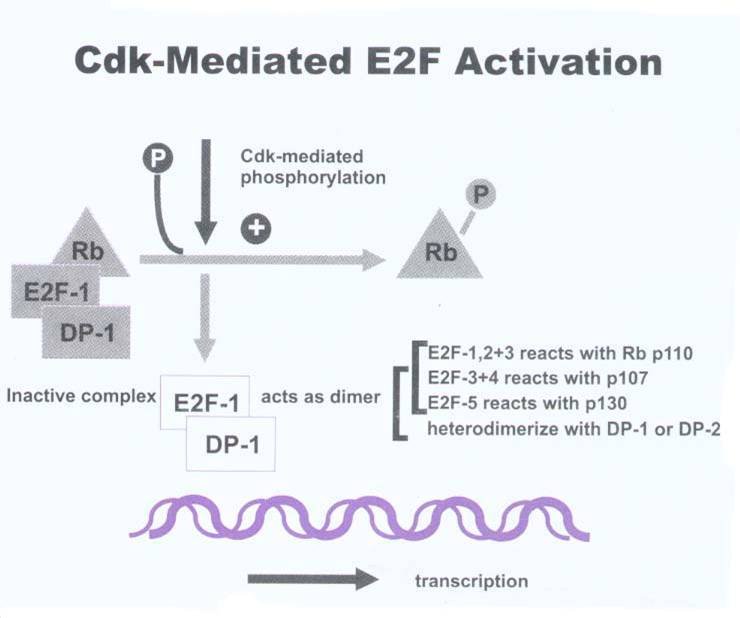 E2F作用图解
E2F作用图解 Rb基因位于人类染色体13q14,其转录产物Rb蛋白是主要的转录信号连接物,在细胞周期中起制动器功能。
它能与转录因子E2F结合并阻止相应基因转录表达,从而抑制细胞生长。
cyclin D是Rb调节细胞周期的基础。cyclin D1-CDK4复合物可看做G1期Rb蛋白激酶,它能结合Rb的N末端,磷酸化Rb蛋白,使转录因子释放,导致G1/S转化。
cyclin D1与Rb的功能是相互依赖的:低磷酸化的Rb还可刺激cyclin D1的转录,使其合成增加,并活化再导致Rb磷酸化,这样形成负反馈环以调节cyclin D1的表达。 CyclinE-CDK2的作用是通过正反馈以促进Rb磷酸化和E2F的释放。
P21结合并抑制多种cyclin-CDK复合物,负性调节CDK功能,实验证明,正常细胞多数cyclin-CDK复合物都与p21结合,而多数转化细胞中则不结合。
P21是P53作用的靶点,p21启动子含有P53结合位点。G1期DNA损伤可激活p53,诱导P21转录,导致cyclin D-CDK4和cyclin E-CDK2抑制,从而阻止细胞进入S期,使损伤DNA得到修复。 p21在p53介导的DNA损伤所致的G1期停滞中起重要作用。
CAK ( CDK激活酶)可诱导CDK磷酸化,而p27通过与CDK亚单位的结合,使CAK不能与CDK直接发生作用。非活化的CDK不能使Rb蛋白磷酸化,使细胞停留在G1期,对细胞周期进行负调控。
P27还可阻止Rb蛋白磷酸化,其过度表达能抑制细胞进入G1期。
p27在调节细胞进入和退出M期中起重要作用,抗丝裂原环境中细胞生长停滞与p27—CDK2复合物的量相关。
细胞在长期的进化过程中发展出了一套保证细胞周期中DNA 复制和染色体分配质量的检查机制, 通常被称为细胞周期检测点(check point)又称为限制点(restriction point) 。这是一类负反馈调节机制。当细胞周期进程中出现异常事件, 如DNA 损伤或DNA 复制受阻,这类调节机制就被激活, 及时地中断细胞周期的运行, 待细胞修复或排除了故障后,细胞周期才能恢复运转。保证了在细胞周期中上一期事件完成以后才开始下一期的事件。
细胞周期检测点的作用:
细胞周期检测点(checkpoints)构成了DNA修复的完整元件。
检测点通过延缓细胞周期的进展,为DNA复制前的修复、基因组的复制、有丝分裂及基因组的分离提供更多的时间。
检测点功能的丢失或减弱可能通过降低DNA复制效率来增加和诱导基因突变和染色体畸变。在某些遗传性癌症和细胞转化早期中,已经观察到检测点调控的缺失,后者可能导致遗传失稳态,促使向新生物转化。
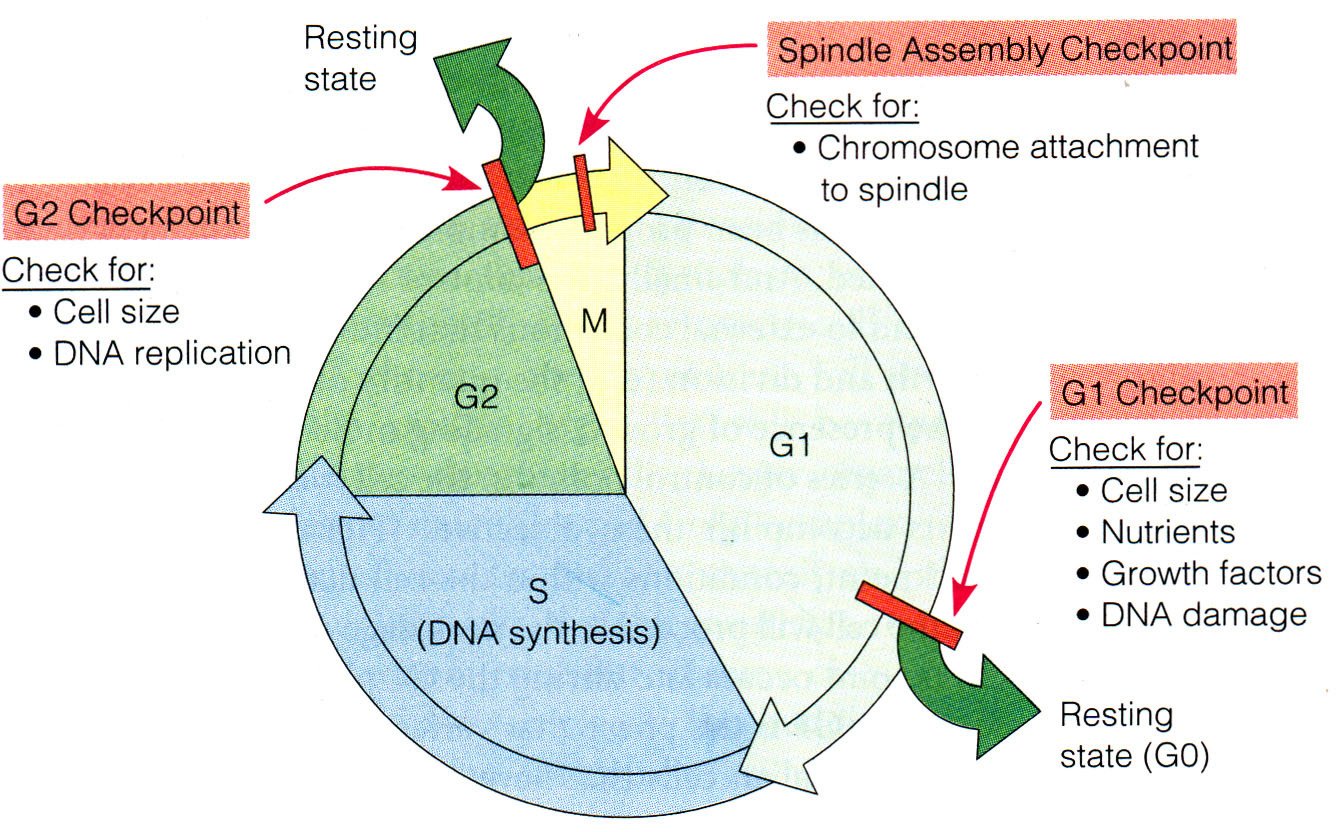 细胞周期的生化事件与检验点
细胞周期的生化事件与检验点 G1-S期检测点是最重要的检测点。细胞在该检测点对各类生长因子、分裂原以及DNA 损伤等复杂的细胞内外信号进行整合和传递,决定细胞是否进行分裂、发生凋亡或是进入G0 期。
细胞顺利完成其周期需经过若干检测点,其中最重要的控制点是G1晚期的START,START调节失灵,将导致细胞越过正常的程序限制进入s期,并允许细胞复制未修复的突变DNA,从而积累形成肿瘤表型的基因改变。
G1-S 期检测点缺陷导致肿瘤的原因主要是p53 缺失和cyclinD1上调。 失去调控的癌细胞倾向于保留在细胞周期中持续循环;一旦细胞通过G1晚期限制点,将对胞外生长调控信号产生不应期而代之以自律性程序,并带着这些信息进入有丝分裂。对限制点调控的研究是搞清癌细胞是怎样和为何持续进入循环的关键所在。
 G1-S期检验点
G1-S期检验点 控制进入S期的检测点(Gl期检测点)可防止DNA受损的细胞进入S期。
控制进入M期的检测点(G2期检测点)可防止受损的DNA和未完成复制的DNA进入有丝分裂。p53 是DNA 损伤诱导G2 期阻滞的关键机制,因此p53 缺失导致的G2 期检测点缺陷与许多肿瘤的发生有关。
M 期检测点又叫纺锤体组装检测点。主要是阻止细胞分裂、阻止细胞两极形成纺锤体、阻止染色体附着到纺锤体上。
细胞周期检测点功能的减弱,会导致突变基因的累积和遗传的不稳定性,但只有当累积的突变基因破坏了细胞周期驱动机制时,细胞才能进入失控性生长。